
Dritter Meinungsaustausch zum Thema Dabigatran (Pradaxa®)
Kosten-Nutzen-Relation
Stellungnahme Physioklin
Seit November 2014 wurde ein „Erster Meinungsaustausch zum Thema Dabigatran (Pradaxa®): Monitoring oder nicht, das ist hier die Frage.“ veröffentlicht, kurz danach ein „Zweiter Meinungsaustausch zum Thema Dabigatran (Pradaxa®): Interessenkonflikt.“
Im ersten Beitrag hat die Fa. Boehringer Ingelheim eine Stellungnahme der Deutschen Gesellschaft für Kardiologie zur öffentlichen Diskussion um die neuen oralen Antikoagulanzien (NOAKs) aus dem Jahre 2014 zitiert, die schon im Untertitel die bemerkenswerte Aussage enthält: „Studien belegen Überlegenheit und Sicherheit, Kosten-Nutzen-Vergleich darf nicht auf Therapiekosten reduziert werden.“
Diese Aussage bezüglich der Kosten-Nutzen-Relation soll hier für Deutschland geprüft werden, wobei folgende Daten für die Jahre 2011 - 2014 verwendet wurden: Verdachtsmeldungen auf unerwünschte Arzneimittelwirkungen (UAW) und Todesfälle gemäß Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) http://nebenwirkung.bfarm.de/apex/f?p=100:1:0 für Vitamin K-Antagonisten (Marcumar, Phenprogamma, Falithrom, Marcuphen CT, Phenprocoumon Acis, Phenpro. ratiopharm, Coumadin, Phenpro AbZ) und Dabigatran (Pradaxa®), bezogen auf jeweils 1 Jahr. Die Abfragen zu den Vitamin K-Antagonisten stammen vom 02.11.2015 und die Mitteilung des BfArM zu Dabigatran vom 15.01.2015.
Die DDD als defined daily dose bezogen auf 1 Jahr in Mio. stammen aus dem Arzneiverordnungsreport 2015 (Hrsg.: U. Schwabe, D. Paffrath, Springer), ebenso die Kosten pro DDD von 0,18 € für die Vitamin K-Antagonisten und 3,23 € für Dabigatran. Die UAW und Todesfälle wurden jeweils bezogen auf 1 Mio. DDD (UAW/Mio, T/Mio.) berechnet.
Aus diesen Daten wurde die folgende Tabelle erstellt:
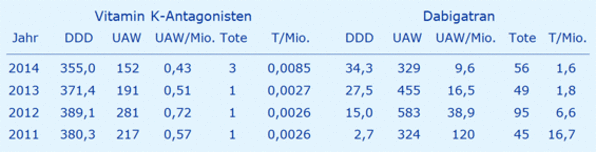
Folgende Schlussfolgerungen können daraus für einen Vergleich zwischen Dabigatran und Vitamin K-Antagonisten (z.B. Marcumar®) abgeleitet werden:
- Fast 200 mal mehr Todesfälle pro 1 Mio. DDD (1,6 : 0,0085 = 188)
- Gut 20 mal mehr Nebenwirkungen pro 1 Mio. DDD (9,6 : 0,43 = 22,3)
- Fast 20 mal höhere Kosten pro DDD (€) (3,23 : 0,18 = 17,9)
- Obwohl Dabigatran nur ca. 10 % des Umsatzes der Vitamin K-Antagonisten ausmacht, verursacht Dabigatran allein 2014 fast das Doppelte an Kosten (34,3 x 3,23 = 111 Mio. €) im Vergleich zu den Vitamin K-Antagonisten (363,7 x 0,18 = 65,5 Mio. €).
Vergleich Dabigatran zu Vitamin K-Antagonisten:
20 mal mehr Kosten / 20 mal mehr UAWs / 200 mal mehr Todesfälle
Fazit
Die Kosten-Nutzen-Relation der Vitamin K-Antagonisten (z. B. Marcumar®) ist hiernach im Vergleich zu Dabigatran (Pradaxa®) eindeutig viel günstiger.
Stellungnahme Fa. Boehringer Ingelheim
05.11.2015
Kommentar zu den Verdachtsmeldungen auf unerwünschte Arzneimittelwirkungen (UAW) und Todesfälle gemäß Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM):
Wie das BfArM selbst auf seiner Webseite schreibt, sind bei der Bewertung von Verdachtsfall-Meldungen einige zentrale Punkte zu beachten (http://www.bfarm.de/DE/Buerger/Arzneimittel/Arzneimittelueberwachung/_node.html)
Dazu gehören:
Wenn ein neues Arzneimittel auf den Markt kommt (z.B. die NOAKs), werden diese Mittel erfahrungsgemäß stärker in den Blick genommen als solche, die sich bereits länger auf dem Markt befinden (z.B. Marcumar).
Es handelt sich bei den Meldungen um Verdachtsfälle. Der direkte Zusammenhang zwischen der Behandlung mit einem Arzneimittel und dem Auftreten einer unerwünschten Wirkung ist also im Einzelfall nicht sicher belegt.
Gerade Patienten mit Vorhofflimmern sind oft ältere Patienten, die an mehreren Erkrankungen leiden und daher oft verschiedene Medikamente einnehmen müssen. Eine eindeutige Zuordnung eines gemeldeten Verdachts zu einem Medikament ist somit kaum möglich.
Gemäß BfArM erfordern Analysen der Häufigkeit von Nebenwirkungen daher ergänzende systematisierte Datensammlungen, wie sie z.B. im Rahmen von klinischen Prüfungen oder Studien zur Sicherheit von Arzneimitteln nach der Zulassung, den sog. „post-authorisation safety studies“ durchgeführt werden.
Genau eine solche Studie zur Sicherheit von Dabigatran hat die FDA in den USA im Rahmen einer groß angelegten Untersuchung von Daten aus der klinischen Praxis gemacht.
Darin hat sie die Ereignisse während einer Therapie mit Warfarin und Dabigatran verglichen. Basis dafür waren die Daten einer großen US-Versicherungsdatenbank, die strukturiert erfasst werden und damit deutlich zuverlässiger sind als Spontanmeldungen aus der klinischen Praxis.
Die FDA hat die Daten von 134.000 Personen analysiert, die übrigens – nur unter Dabigatran – nicht zu regelmäßigen Blutkontrollen in die Praxis kommen mussten.
Die Ergebnisse dieser Analyse waren konsistent mit den Ergebnissen der klinischen RE-LY Studie, auf deren Basis Dabigatran zugelassen wurde. Nur bei den Herzinfarkten wurden in der klinischen Praxis weniger Ereignisse gesehen als in der Studie.
Original-Zitat der FDA: “This study’s findings, except with regard to MI, are consistent with the clinical trial results that provided the basis for Pradaxa’s approval. As a result of our latest findings, we still consider Pradaxa to have a favorable benefit to risk profile and have made no changes to the current label or recommendations for use.”
(Quelle: http://www.fda.gov/Drugs/DrugSafety/ucm396470.htm)
Das bedeutet, dass der Einsatz von Dabigatran im klinischen Alltag genau die gleichen Ergebnisse hervorbringt wie der Einsatz in der klinischen Studie. Damit ist die Sinnhaftigkeit der Zulassung von Dabigatran erneut bestätigt.
Eine ähnlich groß angelegte und fundierte Analyse mit einer so deutlichen und genauen Bestätigung der Studiendaten als Ergebnis ist uns von keinem anderen Medikament bekannt und spricht für sich.
Zudem weisen wir an dieser Stelle noch einmal darauf hin, dass auch das Britische NICE Institut Pradaxa einen positiven Kosten-Nutzen-Vergleich bescheinigt hat.
https://www.nice.org.uk/guidance/ta249
