
Regulation der H+-Konzentration
Stoffwechselendprodukte
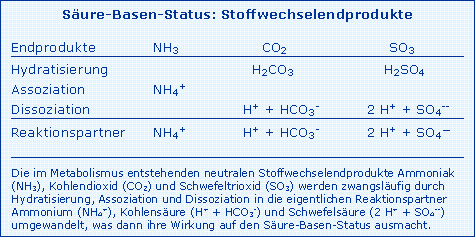
Im Stoffwechsel des Menschen werden laufend Säuren (H+-Donatoren) und Basen (H+-Akzeptoren) produziert, die die Konzentration freier H+-Ionen im Organismus und damit den pH-Wert (negativer dekadischer Logarithmus der H+-Konzentration) beeinflussen müssen. Neben dem obligatorischen Endprodukt H2O sind dies im Metabolismus der Kohlenhydrate und der Lipide das Stoffwechselendprodukt Kohlendioxid (CO2) und weiterhin Schwefeltrioxid (SO3) und Ammoniak (NH3) sowie Wasserstoffionen (H+) im Proteinstoffwechsel. Mit Ausnahme von H2O unterliegen die aufgeführten Endprodukte zwangsläufig Reaktionen wie Hydratisierung (Reaktion mit H2O), Assoziation (Aufnahme von H+) oder Dissoziation (Abgabe von H+), wie in der Tab. Stoffwechselendprodukte beschrieben. Beim physiologischen pH von 7,4 wird aus der Base NH3 (Ammoniak) die Säure NH4+ (Ammonium) (pK bei 9,0), aus CO2 entsteht die dissoziierte Kohlensäure H+ + HCO3- (pK bei 6,1) und aus SO3 die dissoziierte Schwefelsäure 2 H+ + SO4-- (pK1 und pK2 bei 1 - 2). Nicht die neutralen Stoffwechselendprodukte sondern die daraus zwangsläufig entstehenden geladenen Reaktionspartner sind dafür verantwortlich, dass es bei fehlender Elimination zu einer Störung des Säure-Basen-Gleichgewichtes kommt, die sich in einer Abnahme des pH-Wertes (Azidose) oder Zunahme des pH-Wertes (Alkalose) im Extrazellularraum äußert.
Da nur der Extrazellularraum, d. h. repräsentativ dafür das Blutplasma, in direktem Kontakt zu den Eliminationsorganen Lunge, Leber und Nieren steht, ist das Blutplasma das verbindende Organ und somit auch Zielorgan für Diagnostik und Therapie.
Transport der Stoffwechselendprodukte zum Eliminationsorgan
Auf dem Weg von ihrer Bildung bis zum Eliminationsorgan werden die drei genannten Endprodukte in spezielle Transportformen verpackt. Das Gas CO2 wird im Blut vor allem in Form von HCO3- transportiert. Es findet sich deshalb in so hoher Konzentration im Blut, weil das zugehörige "respiratorische" (aus der Kohlensäure stammende) H+ praktisch unbegrenzt vom Hämoglobin abgepuffert werden kann. Unter physiologischen Bedingungen beträgt die HCO3--Konzentration im Blutplasma 24 mmol/l (im Vollblut nur ca. 20 mmol/l, weil die erythrozytäre HCO3--Konzentration deutlich niedriger ist). Dies ist der entscheidende Grund für die Tatsache, dass die CO2-Transportkapazität des Blutes fast zehnmal höher ist als die für Sauerstoff. H+-Ionen anderer Genese hingegen werden praktisch vollständig gepuffert im Blut transportiert, d. h. an H+-Akzeptoren (Pufferbasen) gebunden. In Frage kommen dabei im Wesentlichen wie bei der H2CO3 wiederum das Hämoglobinat (die Pufferbase des Hämoglobins) und das Bikarbonat (HCO3-). Dieses HCO3- nimmt dabei offensichtlich eine bedeutende Sonderrolle ein: Einerseits ist es eine fast unbegrenzte Transportform für CO2, andererseits eine ideale Pufferbase, weil die Reaktionsprodukte nach erfolgter Pufferung (H+ + HCO3- = H2CO3 = CO2 + H2O) sehr einfach über Lunge (CO2) und Niere (H2O) zu eliminieren sind. Trotzdem ist die Pufferbase Hämoglobin dem Bikarbonat überlegen, weil sie sowohl fixe ("nicht-respiratorische") H+-Ionen (z. B. aus Milchsäure, Hydroxy-Buttersäure, Schwefelsäure) als auch flüchtige ("respiratorische") H+-Ionen (aus H2CO3) puffern kann. Das dritte Reaktionsprodukt NH4+ (Ammonium) kann wegen seiner extrem hohen Toxizität nicht im Blut transportiert werden (toxisch ist genaugenommen die als Ammoniak-Gas sehr gut diffusible korrespondierende Base NH3). Aus diesem Grunde müssen spezielle Transportmoleküle von der Leber, dem Hauptlieferanten von NH3 bzw. NH4+, zur Niere produziert werden, Harnstoff einerseits und Glutamin andererseits. Kommt es z. B. zu einer Drosselung der Harnstoffsynthese in der Leber, wird Ammonium zunehmend über eine hepatische Glutaminbildung entgiftet und eine vermehrte Glutaminspaltung in der Niere führt zu einer Ammoniumausscheidung über die Niere. Somit dient Glutamin als nichttoxische Transportform für Ammonium zwischen Leber und Niere.
Zwischenlagerung von Stoffwechselendprodukten
Werden pro Zeit mehr Stoffwechselendprodukte produziert als in den dafür vorgesehenen Organen eliminiert werden können, müssen überschüssiges CO2 und H+-Ionen, nicht aber NH3 bzw. NH4+, vorübergehend im Blut und Extrazellularraum (EZR) zwischengelagert werden. Schlüsselsubstanz hierfür ist das Bikarbonat des Extrazellularraumes. Für den Fall eines Anstiegs des pCO2 als Ergebnis einer mangelhaften CO2-Elimination über die Lunge wird vermehrt HCO3- im Erythrozyten des Blutes gebildet, das überwiegend im Plasma und damit auch im gesamten Extrazellularraum erscheint. Da der gesamte EZR einschließlich Plasma ca. 15 Liter umfasst, können auf diese Weise sehr große Mengen von CO2 als HCO3- gelagert werden. Bei einem Atemstillstand von 10 min Dauer mit Anstieg des pCO2 von 40 auf 80 mmHg sind dies immerhin gut 90 % des gebildeten CO2, also ca. 2,2 l CO2 bzw. 100 mmol HCO3- [Zander 1994]; der pH von Plasma und EZR erreicht 7,21 mit einer HCO3--Konzentration von 31 mmol/l, also einer Zunahme von 7 mmol/l. Bei einem vermehrten Anfall fixer H+-Ionen hingegen werden diese vom HCO3- des gesamten EZR abgepuffert, wobei pro mol gepuffertem H+ jeweils 1 mol CO2 entstehen muss. Die Folge dieser Zwischenlagerung ist also eine Abnahme der HCO3--Konzentration im EZR mit der Folge, dass das entstehende CO2 über die Lunge abgegeben werden muss. Die Zwischenlagerung von H+ im EZR setzt also eine normale Lungenfunktion voraus. Die gleichzeitige Speicherung von CO2 und H+ schließen sich somit gegenseitig aus.
Wo lauern Gefahren?
Störungen des Säure-Basen-Haushaltes entstehen immer dann, wenn Produktion und Elimination von CO2 und H+-Ionen aus dem Gleichgewicht geraten. Im ersten Falle spricht man von einer respiratorischen, im zweiten von einer nicht-respiratorischen Störung. Da die Bildung von Säuren (Protonen-Donatoren) im Metabolismus immer die der Basen (Protonen-Akzeptoren) überwiegt, sind die Entgleisungen zur sauren Seite, also die Azidosen, häufiger als die Alkalosen, d. h. Entgleisungen zur alkalischen Seite. Eine vermehrte CO2-Bildung im Metabolismus kann als Folge einer malignen Hyperthermie einer zusätzlichen CO2-Freisetzung sehr ähnlich sein. Letztere kommt immer dann zustande, wenn kurzfristig H+-Ionen im Organismus entstehen, die zwangsläufig beim Übertritt in den eiweißfreien Extrazellularraum mit HCO3- reagieren müssen und damit zusätzliches CO2 (und H2O) freisetzen, die mit dem Blut zur Lunge transportiert werden. Eine reduzierte CO2-Abgabe über die Lunge im Sinne einer Hypoventilation, als Folge einer Lungenfunktionsstörung des Patienten oder als unzureichende Beatmung, wird ebenfalls eine respiratorische Azidose bedingen. Die Mehrzahl respiratorischer Alkalosen als Ausdruck einer Hyperventilation dürfte selten und dann beatmungsbedingt sein. Auch bei den nicht-respiratorischen Störungen überwiegen eindeutig die Azidosen, und zwar als
- metabolische, wenn eine Stoffwechselstörung vorliegt (z. B. Diabetes mellitus, Lakt-Azidose)
- renale, wenn eine Nierenfunktionsstörung besteht (z. B. Anurie)
- hepatische, wenn die Leberfunktion eingeschränkt ist (z. B. Milchsäure-Verwertungsstörung)
- intestinale, bei Verlust von HCO3- mit dem Duodenalsekret, oder
- iatrogene, wenn dem Patienten über Transfusionen oder Infusionen zusätzliche H+-Ionen zugeführt oder seine HCO3--Vorräte durch Infusionen großer Volumina verbraucht wurden.
Aber auch eine nicht-respiratorische Alkalose kann klinisch beobachtet werden als
- intestinale, wenn vermehrt H+-Ionen verloren gehen (Magensonde) oder
- metabolische (iatrogene), wenn große Mengen sogenannter metabolisierbarer Anionen wie Azetat, Glukonat, Laktat, Malat oder Zitrat parenteral zugeführt wurden.
