
Nebenwirkungen von Infusionslösungen
Säure-Basen-Haushalt
Im Stoffwechsel des Menschen werden laufend Säuren (H+-Donatoren) und Basen (H+-Akzeptoren) produziert, die die Konzentration freier H+-Ionen im Organismus und damit den pH-Wert beeinflussen müssen. Die Freisetzung von Säuren überwiegt praktisch immer die der Basen, was sich dann im Extrazellularraum eher als Abnahme des pH-Wertes (Azidose) oder selten als Zunahme (Alkalose) manifestieren kann. Da nur der Extrazellularraum, dafür repräsentativ ist das Blutplasma, in direktem Kontakt zu den Eliminationsorganen Lunge, Leber und Nieren steht, ist das Blutplasma das Zielorgan für Diagnostik und Therapie.
Die beiden wichtigsten Puffersysteme des Blutes sind das Bikarbonat (Hydrogenkarbonat, HCO3-) und das Hämoglobin (Hämoglobinat). Bikarbonat ist eine ideale Pufferbase, weil die Reaktionsprodukte nach erfolgter Pufferung fixer H+-Ionen (H+ + HCO3- = H2CO3 = CO2 + H2O) sehr einfach über Lunge (CO2) und Niere (H2O) zu eliminieren sind. Andererseits ist die Pufferbase Hämoglobin dem Bikarbonat überlegen, weil sie sowohl fixe (nicht-respiratorische) H+-Ionen (z. B. aus Milchsäure, Hydroxy-Buttersäure, Schwefelsäure) als auch flüchtige (respiratorische) H+-Ionen (aus H2CO3) puffern kann.
Störungen des Säure-Basen-Haushaltes entstehen immer dann, wenn Produktion und Elimination von CO2 und H+-Ionen aus dem Gleichgewicht geraten. Im ersten Falle spricht man von respiratorischer, im zweiten von nicht-respiratorischer Störung. In körperlicher Ruhe eliminieren unter physiologischen Bedingungen in der Reihenfolge ihrer Bedeutung für die Regulation des Säure-Basen-Haushaltes
- die Lunge ca. 10 mmol (224 ml) CO2 pro Minute
- die Leber ca. 50 mmol H+ (als Milchsäure) pro Stunde und
- die Nieren ca. 40 - 80 mmol H+ (als H2PO4- bzw. NH4+) pro Tag.
Für die klinische Praxis bedeutet dies, dass sich im Säure-Basen-Haushalt eine Funktionsstörung der Lungen in wenigen Minuten, eine der Leber in Stunden und eine der Nieren erst in Tagen bemerkbar machen wird.
Funktion der Leber
Die Leber als wesentliches Stoffwechselorgan greift zwangsläufig in den Säure-Basen-Haushalt ein. Bei normaler Nahrungszufuhr werden pro Tag 40 - 80 mmol H+ im Überschuss produziert, die vor allem dem Proteinstoffwechsel entstammen sollen, während die H+-Bilanz des Abbaus von Kohlenhydraten und Fetten praktisch ausgeglichen ist. Für die klinische Praxis sind vor allem der Metabolismus von Aminosäuren und organischer Anionen wichtig.
Die bei der Hydrolyse von Proteinen entstehenden bipolaren, neutralen Aminosäuren liefern im Metabolismus bei vollständiger Oxidation die Endprodukte CO2 und NH3, die keinen Einfluss auf den Säure-Basen-Haushalt ausüben. Werden dem Organismus aber Aminosäuren mit zusätzlichen dissoziierenden Gruppen angeboten, wird der Säure-Basen-Haushalt belastet: Asparagin- und Glutaminsäure liegen im physiologischen pH-Bereich als Basen (Anionen) vor, d. h. als Protonen-Akzeptoren. Um als neutrale Substanzen metabolisiert werden zu können, müssen sie H+-Ionen aufnehmen, also entwickeln sie eine alkalisierende Wirkung. Lysin und Arginin als Säuren, Protonen-Donatoren (Kationen), setzen im neutralen Metabolismus H+-Ionen frei, d. h. sie entwickeln eine ansäuernde Wirkung. Schwefelhaltige Aminosäuren setzen weitere H+ frei, nämlich 2 mol H+ pro 1 mol SO3.
Organische Säuren und deren Salze werden im Lebermetabolismus prinzipiell neutral umgesetzt mit der Folge, dass die Zufuhr einer Säure zuerst eine ansäuernde Wirkung entfaltet, die nach Metabolismus zu CO2 und H2O später wieder aufgehoben wird, während die Zufuhr ihres Salzes (Base) alkalisierend wirkt. Natürlich ist ein intakter Leberstoffwechsel Voraussetzung für den Metabolismus der Basen organischer Säuren. Störungen der O2-Versorgung, Intoxikationen, Leberversagen, Leberparenchymschäden etc. schalten diesen Metabolismus frühzeitig aus. Ob Milchsäure bzw. Laktat bei Leberzirrhose umgesetzt werden kann, wird in der Literatur unterschiedlich beurteilt [Eliahou et al. 1970; Hartmann, Senn 1932 (C), Trudnowski et al. 1967].
Zur Verdeutlichung dieser immensen Stoffwechselleistung der Leber soll folgende Abschätzung vorgenommen werden: Wenn die Leber bei gleicher Durchblutung die O2-Utilisation von normal 17 % auf maximal 85 % verfünffacht, kann sie ihren O2-Verbrauch von ca. 50 auf 250 ml/min steigern. Diese zusätzlichen 200 ml/min bzw. 12.000 ml/h entsprechen 545 mmol O2 (1 mmol = 22,4 ml) bzw. 180 mmol oxidiertem Laktat (3 mmol O2 pro mmol Laktat).
Bei einem Patienten mit 75 kg KG entsprechend 15 l Extrazellularraum würde dies einer Laktat-Konzentration von 12 mmol/l entsprechen. Also könnte die Leber einen BE von - 12 mmol/l innerhalb einer Stunde normalisieren, der O2-Verbrauch von ca. 250 ml/min müsste dazu aber fast verdoppelt werden.
Eine weitere Verdopplung des Lebermetabolismus nur für den Laktatumsatz auf ca. 400 mmol/h würde eine entsprechende Verdopplung der Gesamt-Leber-Durchblutung (Vena portae und Art. hepatica) erforderlich machen.
Funktion der Niere
Die Hauptaufgabe der Niere besteht darin, dem Körper den extrazellulären Bikarbonatvorrat zu erhalten [Zander 1993 (B)]: Bei einer Filtration des Primärharns von 125 ml/min (Inulin-Clearance) werden täglich 180 l Primärharn gebildet, dessen HCO3--Konzentration der des Extrazellularaumes mit 25 mmol/l entsprechen muss (das eiweißhaltige Plasma weist eine HCO3--Konzentration von 24 mmol/l auf).
Die sich daraus pro Tag ergebenden 4.500 mmol HCO3- werden unter physiologischen Bedingungen unter großem Energieaufwand (H+-Sekretion) praktisch vollständig rückresorbiert. Ausgehend von dieser ausgeglichenen Bilanz kann die Niere entweder HCO3- ausscheiden, allein durch Unterlassung der Rückresorption, oder zusätzliche H+-Ionen eliminieren. Da eine Ausscheidung als freie H+-Ionen praktisch nicht möglich ist, müssen diese dann nach Bindung an NH3 als NH4+ oder nach Bindung an HPO42- als H2PO4- eliminiert werden.
Funktion der Lunge
Das Eliminationsorgan Lunge gewährleistet einen alveolären und damit praktisch identischen arteriellen pCO2 von 40 mmHg. Jede Änderung der CO2-Produktion wird automatisch mit einer Änderung der Ventilation beantwortet. Auf diese Weise ist sichergestellt, dass auch sehr hohe gemischtvenöse pCO2-Werte, infolge erhöhter CO2-Freisetzung im Gewebe oder infolge einer Abnahme des Herzminutenvolumens, in jedem Falle auf arteriell 40 mmHg normalisiert werden.
Säure-Basen-Status
Unter dem Säure-Basen-Status versteht man die Summe derjenigen Mess- und Rechengrößen, die eine Diagnostik des Säure-Basen-Haushaltes ermöglichen. Dazu gehören die Messwerte im Plasma für den pH, den Kohlendioxid-Partialdruck pCO2 (mmHg) und den Sauerstoff-Partialdruck pO2 (mmHg) sowie die Hämoglobin-Konzentration cHb (g/dl) des Blutes. Zusätzlich berechnet werden aus diesen Werten die O2-Sättigung (%) und der Base Excess BE (mmol/l) des Blutes. Der pH-Wert des Blutplasmas zeigt an, ob der Säure-Basen-Status im Gleichgewicht ist, ein pH 7,40 gilt als Normwert. Der pCO2 des Blutes beschreibt eine normale oder gestörte CO2-Elimination über die Lunge, ein pCO2 von 40 mmHg gilt als normal. Der berechnete BE des Blutes schließlich charakterisiert die nicht-respiratorische Seite des Säure-Basen-Haushaltes, der Normalwert beträgt 0 mmol/l, die entscheidende Größe zur Beurteilung von Infusionslösungen. Zugleich ist der BE diejenige klinische Größe, die für eine therapeutische Korrektur aller nicht-respiratorischen Störungen des Säure-Basen-Haushaltes benutzt wird.
Dilutions-Azidose
Infusionslösungen ohne die physiologische Pufferbase Bikarbonat erzeugen beim Patienten eine sogenannte Verdünnungs- oder Dilutions-Azidose, da mit der Infusion einer derartigen Lösung die HCO3--Konzentration des gesamten EZR verdünnt, also vermindert wird. Prinzipiell macht es nämlich bei der Entstehung einer Azidose keinen Unterschied, ob die HCO3--Konzentration des Extrazellularraumes abnimmt, weil
- dem Organismus HCO3- nach Pufferung von H+ in Form von CO2 + H2O entzogen wird (HCO3- als ideale Pufferbase einer metabolischen Azidose),
- HCO3- mit dem Darminhalt, z. B. massive Diarrhöe bei Cholera [Watten et al. 1969], oder über eine Darm-Fistel verloren geht,
- verlorengegangenes Blut- bzw. Extrazellularraum-Volumen durch Zufuhr HCO3--freier Lösungen wieder aufgefüllt wird (normovolämische Dilutions-Azidose) oder
- das Extrazellularraum-Volumen durch Zufuhr HCO3--freier Lösungen vergrößert wird (hypervolämische Dilutions-Azidose).
Die Dilutions-Azidose wurde erstmals in vivo qualitativ von Shires und Holman [1948] beschrieben: Sie konnten im Hundeversuch zeigen, dass eine Infusion von 1.500 ml einer 0,9 % NaCl-Lösung in 5 min zu einer Abnahme des arteriellen pH auf 7,20 führte, während dies beim gleichen Volumen einer Lösung von 30 mmol/l NaHCO3 nicht der Fall war. Wegen der kurzen Infusionszeit von nur 5 min bedeutet dies natürlich eine massive Verdünnung des Blutes bzw. Zunahme des Plasmavolumens im Sinne einer Verdopplung, was die Abnahme der Plasma-HCO3--Konzentration von 24 auf ca. 15 mmol/l (pH = 7,20) plausibel erscheinen lässt. Asano et al. [1966] haben diese Hundeversuche später quantifiziert, indem sie über 25 min 3,5 ml/kgKG/min einer 0,9 % NaCl-, 5 % Glucose- oder 5 % Mannitol-Lösung infundierten.
Auch hier konnte der deutliche pH-Abfall bis auf Werte zwischen 7,15 und 7,25 im Sinne einer nicht-respiratorischen Azidose belegt werden. Zugleich wurde bewiesen, dass diese Azidose, wie später bezweifelt, auch ohne Chloridzufuhr auftritt. Übertragen auf den Menschen würde dies allerdings bedeuten, dass ein Patient mit 75 kg KG in 25 min immerhin 6 l einer HCO3--freien Infusionslösung erhalten müsste.
Bei einem EZR von 15 l würde dann bei einer Verdünnung mit 6 l die HCO3--Konzentration des Plasmas auf 17,8 mmol/l abnehmen, was bei einem pCO2 von 40 mmHg einem pH von allerdings nur noch 7,27 entsprechen würde.
Leider wurde die Diskussion der Dilutions-Azidose mit einer Arbeit von Ahnefeld et al. [1969] vorläufig beendet, basierend auf einer Dissertation [Alberts 1967], deren insuffiziente Methodik andernorts besprochen wurde [Zander 1981]: Selbst eine 25-fache Verdünnung des Blutes in vitro mit einem Volumenersatzmittel sollte den Säure-Basen-Status nicht verändern. Unter physiologischen Bedingungen hingegen, d. h. Verdünnung von Frischblut bei 37 °C, O2-Sättigung 96 % und konstantem pCO2 von 40 mmHg, wurde die Dilutions-Azidose in vitro theoretisch abgeleitet und quantifiziert [Zander 1981]: Wird Blut z. B. etwa 1 : 2 mit einem Volumenersatzmittel verdünnt, ergibt sich ein pH von 7,12 mit einer Plasma-HCO3--Konzentration von nur noch 12,5 mmol/l, während eine Verdünnung mit einer HCO3--Lösung von 24 mmol/l keine pH-Änderung zur Folge hat. Die gleiche Verdünnung in vitro bei bereits bestehender Azidose und/oder Anämie führt natürlich sehr viel eher zu einer Dilutions-Azidose [Zander 1981]. Dieser Hinweis ist deshalb notwendig, da Ahnefeld et al. [1969] behaupteten, eine im Schock vorhandene metabolische Störung würde dadurch nicht verstärkt, was so nicht zutreffen kann.
Unter klinischen Bedingungen tritt die Dilutions-Azidose nur bei großen Verdünnungsvolumina auf: Bei normovolämischer Hämodilution mit Haemaccel mit Änderung der Hb-Konzentration von 11 auf 6 g/dl wird der BE um 6 mmol/l abgesenkt, ohne dass sich die Laktat-Konzentration im Sinne einer Gewebehypoxie erhöht hätte [Singbartl et al. 1995]. In neuerer Zeit wird die Existenz der Dilutions-Azidose von einigen Autoren bestritten, als klassisches Beispiel einer verfehlten Beweisführung soll eine Arbeit von Scheingraber et al. [1999] angeführt werden: Die Autoren zeigen, dass eine Infusion von jeweils 30 ml/kg/h 0,9 % NaCl oder Ringer-Laktat, also zwei Lösungen ohne HCO3-, nur im ersten Falle zu einer Azidose führt. Die Autoren haben das Prinzip eines Laktatzusatzes nicht realisiert. Auch eine andere Bezeichnung für die Dilutions-Azidose, nämlich hyperchlorämische Azidose [Prough, Bidani 1999; Scheingraber et al. 1999] oder eine andere Interpretation, nämlich Änderung der renalen HCO3--Rückresorption unter Dilution [Garella et al. 1975], beseitigen nicht das klinische Bild der Dilutions-Azidose. Gerade in jüngster Zeit wird diese Diskussion lebhaft geführt, allein 5 Leserbriefe zu diesem Thema erscheinen zeitgleich [Miller et al. 1997]. Die kausale Interpretation ist eigentlich relativ einfach, wenn man die beiden, den pH-Wert bestimmenden Größen Bikarbonat-Konzentration (cHCO3-) und CO2-Partialdruck (pCO2) mit der sogenannten Henderson-Hasselbalch-Gleichung verknüpft, wie dies in der Abb. Dilutions-Azidose gezeigt ist.
Zusammenfassend kann die Dilutions-Azidose wie folgt beschrieben werden: Eine iatrogene Störung als Symptom einer Bikarbonat-Verdünnung im gesamten Extrazellularraum infolge großer Infusionsvolumina, die hyper- oder hypochlorämisch auftreten kann, je nach Chlorid-Konzentration der eingesetzten Lösung. Da die Chlorid-Konzentration heute routinemäßig erfasst wird, ist das „Chlorid der Sündenbock der Infusionstherapie“ geworden.

Infusions- oder Rebound-Alkalose
Mit einer Infusions-Alkalose muss immer dann gerechnet werden, wenn eine Infusionslösung metabolisierbare Anionen in solchen Konzentrationen enthält, die die ansäuernde Wirkung durch fehlendes Bikarbonat übersteigt. Die entstehende nicht-respiratorische Alkalose, eine metabolische Alkalose, wird als Stoffwechselentgleisung meist entweder bagatellisiert oder als seltene Kuriosität angesehen. Sie tritt bevorzugt postoperativ oder während der Intensivtherapie auf und muss als iatrogen bezeichnet werden [Lit.-Übersicht bei Zander 1993 (B)].
Die eigentliche Ursache für das Auftreten einer Infusions-Alkalose ist meist darin zu sehen, dass die Verstoffwechselung im (vor allem) Lebermetabolismus nicht immer vorhersehbar ist, da z. B. eine Hypothermie, Anästhesie, Parenchymschädigung, Azidose oder zu hohe Infusionsgeschwindigkeit den Umsatz beeinflussen können.
Die Literatur zur Wirkung der genannten metabolisierbaren Anionen ist leider nicht sehr einheitlich, wie folgende Beispiele zeigen sollen: Aus der Arbeit von Brückner [1970] über den Vergleich von Laktat, Azetat und Malat zur Therapie der metabolischen Azidose geht nicht hervor, in welcher Form das Malat von ihm eingesetzt wurde (als zweiwertiges Malat und/oder einwertiges Hydrogenmalat). Daher ist die dort beschriebene geringe Wirkung, im Vergleich zu Laktat und Azetat, so nicht nachzuvollziehen. Wenn Meyer [1973] für Ringer-Malat im Vergleich zu Ringer-Laktat eine deutlich bessere "Pufferkapazität" beschreibt, dann wäre dies, gleiche Konzentrationen von 27 mmol/l und pH von 6 - 7 angenommen, auf die stärker alkalisierende Wirkung des Malats zurückzuführen. Gerade diese Beispiele belegen, wie wichtig eine entsprechende Deklarierung einer Infusionslösung mit den hier vorgeschlagenen Werten für BE und BEpot für die klinische Praxis sein könnte.
Metabolische Alkalosen im Sinne einer Infusions- oder Rebound-Alkalose werden in der Literatur [Eisterer, Riedel 1979; Seeling, Ahnefeld 1988; Seldin, Giebisch 1989; Zander 1993 (B)] wie folgt charakterisiert: Sie sind häufig in der operativen Medizin bzw. "the most common clinical acid-base abnormality observed in hospitalized patients", oft iatrogen durch Infusion metabolisierbarer Anionen im Sinne einer überschießenden Zufuhr von Azetat, Laktat, Malat und Zitrat entstanden, weder seltene noch harmlose Störungen mit einer auffallend hohen Mortalität.
Postoperative metabolische Alkalosen werden bevorzugt dann auftreten, wenn die Leberfunktion intraoperativ mehr oder weniger reduziert wurde und keine metabolisierbaren Anionen umgesetzt werden konnten. Dies gilt zum Beispiel für eine Halothan-Narkose, Operation in Hypothermie, Extrakorporale Zirkulation oder Lebertransplantation. In der Pädiatrie gelten sie daher als eine Komplikation nach EKZ unter Hypothermie [Schranz et al. 1995]. Einschränkend muss vermerkt werden, dass Laktat im Tierversuch nach Hepatektomie und Nephrektomie im größeren Ausmaß auch extrahepatisch umgesetzt werden kann, wobei dann das Laktat anstelle der Glukose zur Energiegewinnung verwandt wird [Drury et al. 1955].
Die größte Problematik der in einigen Stunden entstehenden metabolischen Alkalose besteht in der zwangsläufig einsetzenden, kompensatorischen Hypoventilation, die aber die Alkalose nur teilweise kompensiert [Seldin, Giebisch 1989]. Bei einem extremen BE von + 20 mmol/l würde im Rahmen einer Teilkompensation ein pCO2 von 55 mmHg und ein pH von 7,54 resultieren, dabei würde der arterielle pO2 auf ca. 65 mmHg abfallen [Nunn 1993], was zu einer Reduzierung der arteriellen O2-Sättigung auf etwa 92 - 93 % führen müsste. Die Hypoxämie des Patienten, d. h. Abnahme der arteriellen O2-Konzentration, mit möglicher Gewebehypoxie (Linksverlagerung der O2-Bindungskurve) in Verbindung mit einer deutlichen Abnahme des ionisierten Calciums im Extrazellularraum (Änderung des Gleichgewichts zwischen ionisiertem und proteingebundenem Calcium) begründen die klinische Symptomatik von Somnolenz und Atemdepression. Aber: Atemdepression (Kompensation der Alkalose) und gesteigerter O2-Verbrauch (Metabolismus der Anionen) sind eine denkbar schlechte Kombination.
Lakt-Azidose
Die Lakt-Azidose vom Typ A kann vorwiegend als Folge einer vermehrten, hypoxisch bedingten Milchsäure-Produktion bei gleichzeitiger Reduktion des Laktat-Abbaus in der Leber (Minderperfusion, Azidose) interpretiert werden.
Bezüglich der Therapie erscheint es fraglich, diese Azidose erst ab einem pH von etwa 7,20 ("safe state") therapeutisch anzugehen [Cohen, Woods 1983], besser ist der Vorschlag [Hindman 1990], die Azidose nicht bis zu einem pH von 7,40 zu normalisieren. Sinnvoll erscheint ein "Sicherheitsbereich" von pH = 7,20 und pCO2 von 20 mmHg, die beide nicht unterschritten werden sollten [Zander 1993 (B)], da jede, insbesondere rasche Korrektur eines negativen BE-Wertes zwangsläufig nach Minuten oder Stunden eine "rebound alkalinization" [Hindman 1990] bzw. einen "alkaline overshoot" [Cohen, Woods 1983] zur Folge haben muss, da die primäre Therapie der erhöhten H+-Ionen-Konzentration (Azidose) nach Wiedereinsetzen des Leberstoffwechsels zu einem positiven BE-Wert (Alkalose) gleichen Ausmaßes führen muss, wenn das verbliebene Laktat mit H+ verstoffwechselt wird. Unter diesem Gesichtspunkt ist auch der Hinweis notwendig, dass der BE-Wert unter Lakt-Azidose solange mit der Laktat-Konzentration übereinstimmen sollte [Zander, Lachtermann 1999], solange keine Azidose-Therapie eingeleitet wurde. Dies gilt für HCO3- ebenso wie für Laktat, insofern kann die Erwartung einer Proportionalität zwischen BE und cLaktat natürlich nicht erfüllt werden, wenn in einer Untersuchung zwar HCO3--Gaben ausgeschlossen, die Zufuhr von Ringer-Laktat aber zugelassen wurde [Mikulascheck et al. 1966].
Die Frage, ob HCO3- oder Laktat das Mittel der Wahl bei einer Lakt-Azidose sei, ist wiederholt ausführlich besprochen worden, exemplarisch können dazu zwei Editorials mit unterschiedlicher Position erwähnt werden [Schwartz, Waters 1962; Stacpoole 1986].
Laktat und Laktat-Diagnostik
Der quantitative Nachweis von Laktat im Plasma (Normalwert 1,5 ± 0,5 mmol/l) eines Patienten gilt als ein möglicher Marker einer lokalisierten oder generellen Gewebehypoxie, heute umso mehr, als Laktat-Elektroden in der klinischen Routine für eine schnelle Diagnostik eingesetzt werden können. Diese Diagnostik von Laktat als Hypoxie-Marker muss versagen, wenn routinemäßig Infusionslösungen mit Laktatzusatz eingesetzt werden. Wird Laktat mit Infusionslösungen appliziert, steigt logischerweise die Laktat-Konzentration an [Raum et al. 2002].
Enthält eine Infusionslösung nicht L-Laktat sondern ein Gemisch von L- und D-Laktat, das sogenannte Racemat (früher als r-Laktat, heute als DL-Laktat bezeichnet), wie ursprünglich von Hartmann und Senn [1932] für Ringer-Laktat vorgeschlagen und am Patienten erprobt, dann bricht die Laktat-Diagnostik zumindest teilweise zusammen, weil der übliche enzymatische Nachweis und damit auch die Laktat-Elektrode nur L-Laktat erfassen kann.
In Deutschland wird ausschließlich L-Laktat in Infusionslösungen verwendet, in den USA aber immer noch DL-Laktat (früher r-Laktat), also teilweise D-Laktat, das mit der üblichen Diagnostik nicht erfasst wird. Außerdem betrifft dies ein neues Krankheitsbild, die sogenannte D-Milchsäure-Azidose: Eine Azidose mit negativem BE und "normaler" Laktat-Konzentration [Uribarri, Carroll 1998].
Gemäß Europäischem Arzneibuch [2002] muss die Verwendung von D-Laktat deklariert werden. Zum Vergleich: Eine in den USA vertriebene Volumenersatzlösung, Hextend (6 % hetastarch in lactated electrolyte injection, Abbott), enthält nach Herstellerangaben 28 mmol/l Laktat, die sich nach eigenen Messungen [Zander, unveröffentlichte Daten] zu jeweils 50 % auf D- und L-Laktat verteilen (Messwerte: D-Laktat 14,0 und L-Laktat 13,2 mmol/l).
Laktat im Schock
Der Empfehlung [Seeling, Ahnefeld 1988], bei Volumenmangelschock mit Lakt-Azidose dürfe Ringer-Laktat-Lösung unbedenklich verwendet werden, stehen mindestens fünf Argumente entgegen:
- Da Laktat vornehmlich hepatisch metabolisiert wird, kann es bei Volumenmangelschock mit Lakt-Azidose nicht eingesetzt werden, da die Lakt-Azidose ja gerade Ausdruck eines gestörten hepatischen Laktat-Abbaus ist.
- Wird Laktat nicht umgesetzt, verstärkt Ringer-Laktat über eine Dilutions-Azidose die bestehende Azidose.
- Die Gefahr einer Rebound-Alkalose ist bei Laktat besonders groß, weil sich exogenes und endogenes Laktat addieren können.
- Die Steigerung des O2-Verbrauches ist zu groß und sollte bei bestehender Gewebehypoxie nicht erhöht werden.
- Die Laktat-Diagnostik im Plasma (Normalwert 1,5 ± 0,5 mmol/l) im Sinne eines Hypoxie-Markers wird verhindert, wenn Laktat exogen zugeführt wird.
Wird Laktat trotzdem eingesetzt, sollte ausschließlich L-Laktat verwendet werden, andernfalls muss der Hersteller dies deklarieren, wie für Europa vorgeschrieben.
Mortalität von Polytrauma-Patienten
Als bester Indikator einer Quantifizierung eines akuten Blutverlustes im Tierversuch hat sich ein negativer Base Excess (Basen-Defizit) des arteriellen Blutes erwiesen und war damit 27 anderen hämodynamischen und laborchemischen Messwerten überlegen [Waisman et al. 1993].
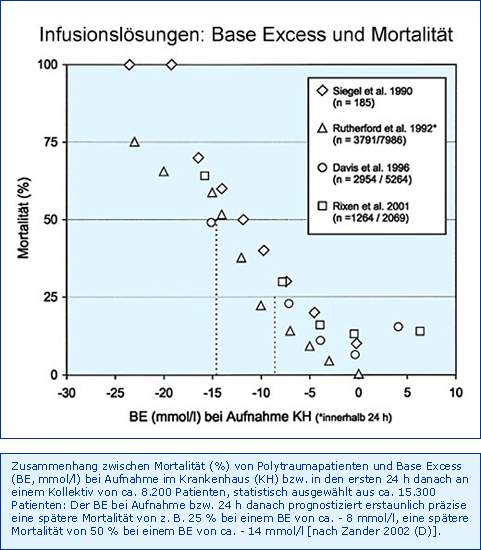
Erste Beobachtungen aus dem Jahre 1979 an 50 Patienten deuteten bereits darauf hin, dass der BE auch für Polytrauma-Patienten ein guter Prognose-Indikator sein könnte [Oestern et al. 1979]. Seit 1990 wurde folgerichtig in vier klinischen Studien [Siegel et al. 1990; Rutherford et al. 1992; Davis et al. 1996, Rixen et al. 2001] an ca. 8.000 Polytrauma-Patienten belegt, dass der Base Excess des Patienten bei Klinikeinweisung tatsächlich im Vergleich zu einer großen Zahl anderer geprüfter Parameter den besten Prognose-Indikator darstellt bezüglich Mortalität, Komplikationsrate, Transfusionsbedarf etc. Zusätzlich konnte auch gezeigt werden, dass diese Aussage auch für den Zusammenhang zwischen BE bei Aufnahme auf die Intensivstation und der späteren Mortalität gilt [Smith et al. 2001; Rixen et al. 2002]. Die Ergebnisse sind in der Abb. Base Excess und Mortalität zusammengefasst. Natürlich können alle diese Daten nicht belegen, dass ein kausaler Zusammenhang zwischen beiden Größen besteht, also im Sinne von, der Base Excess bestimmt die Mortalität. Dieser Gedanke könnte sich aufdrängen, wenn die zeitgleiche Volumengabe betrachtet wird: In den gleichen Studien wurde nämlich ermittelt, dass die Volumengabe in den ersten 24 Stunden bzw. bis zur Aufnahme auf der Intensivstation für Kristalloide und Kolloide zusammen zwischen 5 und 14 Liter beträgt, in einem Falle allein auf Ringer-Laktat entfallend [Davis et al. 1996]. Zumindest aber kann daraus die Forderung abgeleitet werden, den Säure-Basen-Status eines Polytrauma-Patienten nicht zusätzlich mit Infusionslösungen zu belasten, die seinen Base Excess negativ beeinflussen.
Elektrolyt- und Säure-Basen-Haushalt
Die täglich über den Urin eliminierten Wasserstoff-Ionen (H+) entstammen normalerweise fast ausschließlich dem Metabolismus der Schwefel (S)-haltigen Aminosäuren Methionin und Cystein, unter Nahrungskarenz vor allem dem Bindegewebs-Umbau mit seinen S-haltigen Bausteinen (Dermatan-, Chondroitin-, Keratansulfat etc.). Für jedes entstandene mol Sulfat (SO42-) werden nach Hydratisierung zur Schwefelsäure (H2SO4) zwei mol H+ freigesetzt (2 H+ + SO42-), die nur gebunden an einen Puffer über die Niere ausgeschieden werden können. Die tägliche Elimination von 25 mmol Sulfat bedingt somit eine Ausscheidung von 50 mmol H+, die etwa jeweils zur Hälfte als Phosphat und Ammonium ausgeschieden werden. Zusätzlich werden pro mol Sulfat zwei mol Kalium eliminiert, beide aus dem IZR stammend.
Die Aufgabe der Niere besteht nun darin, dieses „Puzzle“ zu lösen, nämlich unter Wahrung der Elektroneutralität
- die Osmolarität des Extrazellularraumes (Wasser, Natrium, Chlorid) bzw.
- des Intrazellularraumes (Kalium) zu regeln und
- die obligatorischen H+-Ionen mit Phosphat und Ammonium zu eliminieren sowie
- die harnpflichtigen Substanzen, vor allem Harnstoff und Ammonium, auszuscheiden.
Die Verknüpfung von Säure-Basen- und Elektrolythaushalt ist offensichtlich: Die obligatorische Sulfat-Ausscheidung bedingt die Elimination von H+-Ionen, somit auch die von Phosphat, Ammonium und Kalium, während extrazelluläres Natrium und Chlorid mit Wasser vornehmlich die Osmolarität und damit den Volumenstatus des EZR definieren. Damit ist offensichtlich, dass jede unphysiologisch zusammengesetzte Infusionslösung einen Einfluss auf die jeweils andere Seite ausüben kann, nämlich der Elektrolyt-Status der Lösung auf den Säure-Basen-Status des Patienten und umgekehrt der Säure-Basen-Status der Lösung auf den Elektrolyt-Status des Patienten.
