
Extreme Anämie nach postpartaler Blutung
R. Zander (Mainz), Petra Seeber (Gotha), Reinhold Romics (Aalen)
Fragestellung
Das sogenannte „Patient Blood Management“ (PBM) ist ein multidisziplinäres, evidenzbasiertes Behandlungskonzept zur Reduktion von Anämie und Blutverlust, mit dem die Anzahl an Transfusionen deutlich reduziert werden kann [7]. Als ein Beispiel für das PBM wird anhand einer aktuellen Krankengeschichte einer Zeugin Jehovas demonstriert, welche extremen Werte der Hämoglobinkonzentration unter Umständen toleriert werden können. Die Krankenakte aus dem Jahre 2013 wurde von der Patientin freundlicherweise zur Verfügung gestellt. Bezüglich des besonderen intraoperativen Vorgehens bei Zeugen Jehovas wird auf eine Übersicht verwiesen [1].

Diagnostik und Therapie
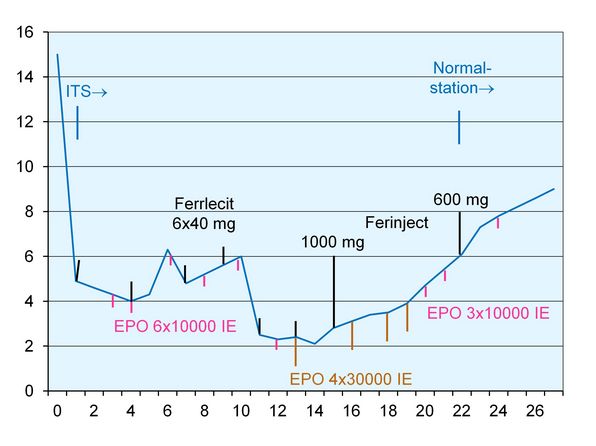
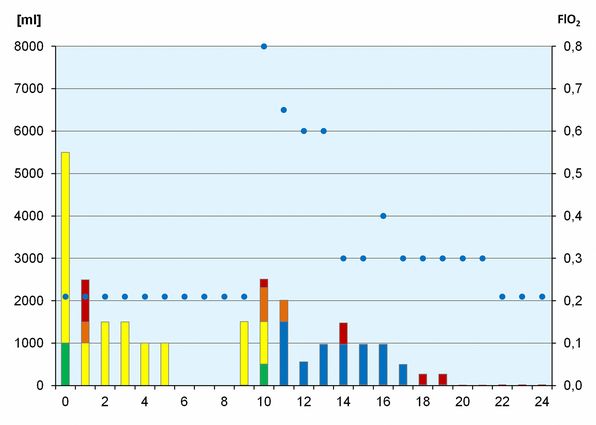
Der Verlauf der Hämoglobin-Konzentration zusammen mit den Maßnahmen zur Stimulation der Erythropoese sind in der Abb. 1 dargestellt. Das Infusionsregime sowie die inspiratorische O2-Fraktion finden sich in Abb. 2.
Diskussion
Erythropoese
Die Abb. 1 zeigt die konsequente Stimulation der Erythropoese mit Erythropoetin (EPO) in Verbindung mit einer simultanen Eisentherapie. Es ist offensichtlich, dass diese Therapie zu einem relativ schnellen Anstieg der cHb in wenigen Tagen führt. Die nicht unerheblichen Kosten für die 210.000 IE EPO (ca. 1.800 €) dürften vergleichbar sein mit den „eingesparten“ ca. 10 - 15 Erythrozytenkonzentraten.
Gerinnung
Anhand der Krankenakte kann nicht geklärt werden, inwieweit eine Gerinnungsstörung den Krankenverlauf mit bestimmt hat. Die intraoperative Verabreichung von Fibrinogen, PPSB und Tranexamsäure (TXA) haben offensichtlich ausgereicht, leider liegen die entsprechenden Dosierungen nicht vor.
Blutvolumen
Aus den praktisch immer normalen Blutdruckwerten (RR) darf geschlossen werden, dass das Blutvolumen weitgehend konstant gehalten werden konnte. Dies trotz der Tatsache, dass praktisch nur kristalline Lösungen eingesetzt wurden, wie die Abb. 2 verdeutlicht.
Diese wurden allerdings in erheblichem Umfang infundiert, nämlich bis zu 6,5 Liter am Tag 0 und bis zu 2,5 Liter am Tag 10, den beiden kritischen Tagen. Die Auswahl der verwendeten Lösungen lässt allerdings zu wünschen übrig: Ringer-Lösung und Ringer-Laktat-Lösung sollten heute durch balancierte Lösungen ersetzt werden. Dies gilt insbesondere für die obsolete 0,9 % NaCl.
Der großzügige Einsatz von Olimel wäre auch zu hinterfragen, da es sich hierbei um eine Lösung zur parenteralen Ernährung handelt (Drei-Kammer-Beutel aus Glukoselösung, Lipidemulsion und Aminosäurelösung mit Elektrolyten), die bei einer kritischen cHb von 2 - 3 g/dl nicht indiziert sein dürfte. Der BEpot, in der Fachinformation nicht angegeben, liegt nahe 0 mmol/l.
Hypoxie-Zeichen
Myokard
Der Vermerk im Krankenblatt am Tag 1 (cHb 4,1 g/dl) „Tachykardie bei geringer Belastung“ sowie „Tachykardie“ am Tag 2 - 4 und Tag 13 (cHb 2,4 g/dl) zeigt sehr deutlich, dass die kardiale Kompensation über eine Steigerung des Herzminutenvolumens am Limit angelangt ist: Die Zunahme des Schlagvolumens reicht nicht mehr aus und muss über eine Steigerung der Herzfrequenz weiter erhöht werden.
Base Excess BE
Die vom Tag 0 - 3 sowie 10 - 21 täglich, teilweise mehrmals durchgeführten insgesamt 17 Bestimmungen des Säure-Basen-Status haben nur Werte des BE zwischen -2,7 und +2,5 mmol/l ergeben. Somit lag zu keinem Zeitpunkt eine zu befürchtende, hypoxiebedingte metabolische Azidose vor.
Laktat-Konzentration
Auch wenn die Laktat-Konzentration nicht gemessen wurde, darf doch unterstellt werden, dass keine Erhöhung derselben vorgelegen hat, da der BE zu allen Zeitpunkten normal war. Zur Veranschaulichung dieses Phänomens sind die beiden folgenden Abbildungen 3 und 4 wiedergegeben. Sie zeigen, dass sowohl für Kinder als auch Erwachsene höheren Alters extreme Hb-Konzentrationen bis zu 3 g/dl (Kinder) bzw. 5 g/dl (Erwachsene höheren Alters) toleriert werden, d. h., dass der Hypoxie-Marker Laktat auffällig konstant bleibt. Die Abbildungen zeigen aber auch, dass geringfügige Zunahmen der O2-Aufnahme registriert werden, die als Ausdruck der Steigerung des Herzminutenvolumens und damit des O2-Verbrauchs des Herzens interpretiert werden dürfen.
Die Abbildung 3 zeigt zusätzlich noch zwei Besonderheiten. Kinder unter einer Leber-Resektion zeigen erwartungsgemäß bei Abnahme der cHb einen Anstieg der Laktat-Konzentration, weil die Leber als Ort des Laktat-Abbaus vorübergehend ausfällt. Werden Kinder unter einer FIO2 von 1,0 operiert, kann die cHb anstandslos auf nur noch 3 g/dl gesenkt werden, ohne dass die Laktat-Konzentration ansteigt.
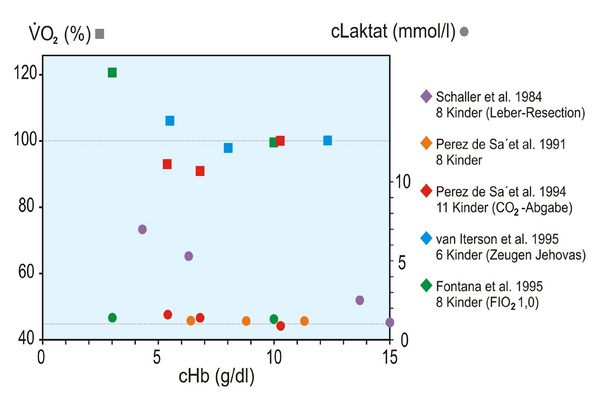
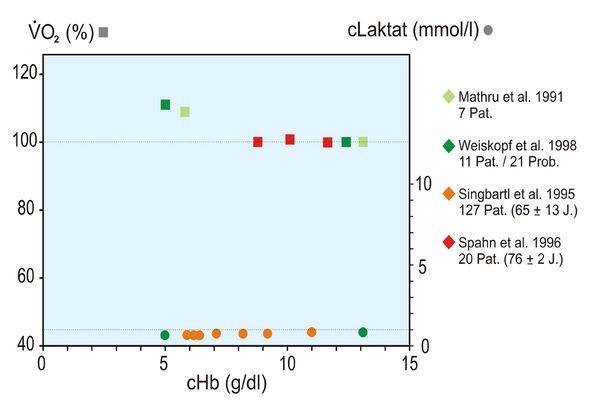
Die in den Abb. 3 und 4 angegebenen 9 Literaturstellen finden sich hier [5].
Limitierender Faktor einer extremen Anämie
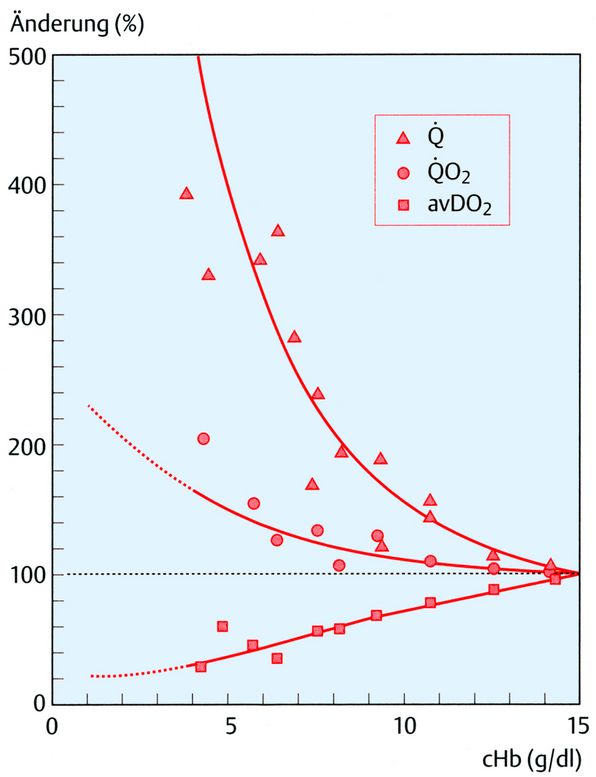
Limitierendes Organ jeder Anämie, also Abnahme der cHb, ist das Myokard, weil es bereits in Ruhe eine Utilisation des arteriell angebotenen Sauerstoffs von 50 - 60 % aufweist, als arterio-venöse O2-Differenz bezeichnet (avDO2). Da jede Anämie im Sinne des Gesamt-Organismus mit einer Steigerung des Herzminutenvolumens beantwortet werden muss, sollte man erwarten, dass auch der O2-Verbrauch des Myokards entsprechend zunimmt. Dies ist allerdings nicht der Fall, vermutlich aufgrund der abnehmenden Viskosität des Blutes. Entscheidender Faktor für das Myokard ist die Zunahme der Koronardurchblutung. Das gesunde Herz kann die Koronardurchblutung um den Faktor 5 steigern, als Koronarreserve bezeichnet. Offensichtlich wird die Koronardurchblutung überproportional gesteigert, das bedeutet, dass die avDO2 überproportional abfällt. Diese Verhältnisse sind in der Abb. 5 anhand von 5 Tierversuchsstudien dargestellt. Dort ist zu sehen, dass die avDO2 bei einer cHb von 3 g/dl auf nur noch ca. 25 % abgefallen ist. Ausgehend vom Normalwert der O2-Konzentration (cO2) von 20 ml/dl werden jetzt nur noch 5 ml/dl (25 %) utilisiert. Bei einer cHb von 3 g/dl beträgt die arterielle cO2 nur noch 4,1 ml/dl chemisch gebundenen O2 (3 x 1,39 x 0,98) plus 0,3 ml/dl physikalisch gelösten O2, also insgesamt 4,4 ml/dl. Diese Betrachtung zeigt, dass hier tatsächlich eine Grenzbetrachtung vorliegt, 4,4 ml/dl werden angeboten und ca. 5 ml/dl sollen verbraucht werden.
Zusätzlich taucht hier eine weitere Fragestellung auf, nämlich die, ob das Myokard den arteriell angebotenen O2 vollständig utilisieren kann.
Grundsätzlich können alle Organe - mit zwei Ausnahmen bei unterschiedlicher Begründung - den mit dem arteriellen Blut angebotenen Sauerstoff praktisch vollständig utilisieren.
Wegen seiner speziellen O2-Versorgungsbedingungen benötigt das ZNS zumindest zum Erhalt des Bewusstseins einen venösen pO2 von 20 mmHg und die Nieren können, wegen ihrer sehr großen Durchblutung im Sinne der Ausscheidung, den angebotenen Sauerstoff nur zu einem kleinen Teil verbrauchen. Für alle anderen Organe aber gilt diese Aussage, insbesondere für das Myokard, für das der minimale pvO2 am Menschen mit etwa 5 mmHg bestimmt wurde, und auch für die Leber, die im Tierversuch eine Utilisation von 97 - 100 % erreichen kann [4].
In der Abb. 5 ist die prozentuale Änderung von Durchblutung (Q), O2-Verbrauch (QO2) und arterio-venöser O2-Differenz (avDO2) des Herzens im Tierversuch als Funktion der Hb-Konzentration (cHb g/dl) dargestellt. Es wurden die Daten von insgesamt 5 Autoren verwendet, sie gelten für eine isovolämische Hämodilution unter Normoxie. Die idealisierten Funktionen berücksichtigen die Verknüpfung der drei Größen (QO2 = Q x avDO2). Bei einer cHb von 3 g/dl kann die maximal fünffache Steigerung der Koronardurchblutung, bei relativ geringem Anstieg des O2-Verbrauchs, die avDO2 auf ca. 25 % des Ausgangswertes senken.
Bei Hyperoxie ergibt dies eine Verschiebung auf 1,5 g/dl. Die in der Abb. 5 angegebenen 5 Literaturstellen finden sich hier [3].
Wirkung einer Hyperoxie
Insbesondere während einer akuten Anämie kann kurzfristig über eine Hyperoxie (FIO2 1,0 bzw. 100% O2) mit dem erhöhten Anteil von physikalisch gelöstem O2 von 2 ml/dl ein Hb-Defizit von 1,5 g/dl ersetzt werden, da Hb den gleichen Betrag an O2 transportieren kann.
Die Gabe von 2 Erythrozytenkonzentraten von je 350 ml (cHb 19 g/dl) führt nach Transfusion zu einer Erhöhung der cHb um 1,5 g/dl. Das bedeutet, dass die extreme cHb theoretisch um weitere 1,5 g/dl von 3,0 auf 1,5 g/dl gesenkt werden könnte.
Für den klinischen Alltag kann so unter einer akuten Anämie kurzfristig innerhalb von wenigen Minuten über eine Hyperoxie (FIO2 1,0) ein Hb-Defizit von 1,5 g/dl ersetzt werden. Damit wird die Hyperoxie zum schnellen Instrument der Diagnostik und der Therapie: Fragliche Symptome eines O2-Mangels können ausgeschlossen werden oder nicht, werden die Hypoxie-Symptome aufgehoben, kann die Hyperoxie sofort therapeutisch genutzt werden, bis die notwendigen Erythrozytenkonzentrate bereitstehen [6].
Die Hyperoxie wurde ab Tag 10 konsequent eingesetzt, wie in Abb. 2 dargestellt (am Tag 10 aus optischen Gründen bei 0,8 statt 1,0 eingetragen).
Fazit
Als ein typisches Beispiel für das sogenannte „Patient Blood Management“ wird der Krankenverlauf einer Zeugin Jehovas vorgestellt. Damit wird demonstriert, dass auch extreme Anämien, hier mit einer cHb von 2,1 g/dl, überlebt werden können, solange ein Patient mit normaler Herzfunktion und Blutvolumen unter vorübergehender Hyperoxie anstelle von Bluttransfusionen mit Therapeutika zur Steigerung der Erythropoese versorgt wird. Entscheidende Voraussetzung dafür ist die „Motivation der Therapeuten, sich mit der Transfusionsindikation in jedem einzelnen Fall kritisch auseinanderzusetzen und darüber hinaus sämtliche technischen und medikamentösen Möglichkeiten zu nutzen, um Fremdbluttransfusionen zu vermeiden“ [2].
Anmerkungen
Missverständnisse
Es wird deutlich darauf hingewiesen, dass das Tolerieren einer Anämie kein Therapieziel ist, sondern dass in jedem Fall alles getan werden sollte, um eine so schwere Anämie zu verhindern.
Einschränkungen
Der Schwangerschafts- und der Geburtsverlauf werfen zahlreiche Fragen auf, die hier nicht diskutiert werden konnten und sollten.
- Wann und wo im Verlauf der Schwangerschaft hätten die Weichen anders gestellt werden können: Wenn in Deutschland etwa ein Drittel aller Kinder per Sectio geboren werden (stat. Bundesamt 31,9 %), ist die Spontan-Geburt eines Kindes von 4750 g zu diskutieren. Dies auch dann, wenn die sonografische Gewichtsbestimmung mit einer Genauigkeit von nur ca. ± 10 - 20 % bei einer Erstgebärenden einer Schätzung gleichkommt. Die Genauigkeit der Gewichtsschätzung hängt zum einen vom verwendeten Berechnungsalgorithmus ab, zum anderen von den klinischen Gegebenheiten (Gewicht der Mutter, Fruchtwassermenge, Kindslage etc.) und der Erfahrung des Untersuchers. Die vermutete Makrosomie des Kindes hätte den Geburtshelfer dann zusätzlich für eine mögliche Atonie sensibilisiert.
- Die Differentialdiagnose der postpartalen Hämorrhagie als Notfall-Management umfasst:
- Trauma (ca. 20 %): Geburtsverletzung (Uterus, Vagina, Vulva, Rectum).
- Tissue: Gewebsreste der Plazenta und Eihäute in der Gebärmutter (Curettage).
- Thrombus: Gerinnungsstörungen (DIC, Faktorenmangel etc.).
- Tonus (ca. 75 %): Atonie der Gebärmutter, Therapie konservativ (Oxytocin, Prostaglandine, Infusionstherapie, Gerinnungsmanagement) oder operativ (Uterustamponade, -arterienembolisation und -balloon, chirurg. Verfahren mit/ohne Hysterektomie).
Literatur
- Habler O, Voß
Perioperatives Management bei Zeugen Jehovas
Anaesthesist 2010; 59: 297 - 311 - von Bormann B
Klinische Aspekte der Therapie mit Erythrozyten
„Lessons learned“ von den Zeugen Jehovas?
Anaesthesist 2007; 56: 380 – 384 - Zander R
Sauerstoff-Versorgung und Säure-Basen-Status bei extremer Anämie
Anästhesiol Intensivmed Notfallmed Schmerzther 1996; 31: 492 - 494 - Zander R
Kompensationsmechanismen der perioperativen Anämie
Anästhesiol Intensivmed Notfallmed Schmerzther 2002; 37: 752 - 755 - Zander R
Physiologie und Pathophysiologie einer Therapie mit Erythrozyten
In: Fortschritt und Fortbildung in der Medizin, Bd. 27 (Hrsg. Bundesärztekammer)
Deutscher Ärzte-Verlag, Köln 2003; 149 - 155 - Zander R
Physiologie und klinischer Nutzen einer Hyperoxie
Anästhesiol Intensivmed Notfallmed Schmerzther 2005; 40: 616 – 623 - Zacharowski K, Meybohm P
Rationaler Einsatz von Blutprodukten – Neue Wege mit einem „alten Saft“
Anästhesiol Intensivmed Notfallmed Schmerzther 2012; 47: 396 - 397
Eine Sendung des Südwest-Rundfunks vom 26.11.2014 kann unter "Patient Blood Management der Universität Frankfurt" unter dem Titel "Böses Blut" eingesehen werden.
