
Statement POC – insbesondere Gerinnungsdiagnostik
(Point of Care, Patienten-nahe Sofort-Diagnostik)
unter besonderer Berücksichtigung der Gerinnungs-Diagnostik
Vorbemerkungen
- Die Vorteile von POC bestehen darin, dass die Diagnostik nah am Patienten (bedside), schnell, weitgehend wartungsfrei und ohne spezielle Vorkenntnisse des Arztes erfolgen kann.
- Ein weiterer - entscheidender - Vorteil besteht darin, dass die Diagnostik auf die aktuellen (in vivo) Patienten-Bedingungen bezogen werden kann, während das Zentrallabor vielfach standardisierte Bedingungen (in vitro) anstrebt. Wird bei POC, wie aktuell zu befürchten, dieses Ziel, also "Patient in vivo" statt "Labor in vitro" aufgegeben, gehen viele Vorteile von POC verloren, was aktuell am Beispiel der Gerinnungs-Diagnostik demonstriert werden soll: Entscheidende Aspekte der Diagnostik fehlen dem Arzt.
- Das Plus dieser Patienten-bezogenen In-vivo-Diagnostik setzt oftmals voraus, dass die zu untersuchende Probe unter speziellen Bedingungen (z. B. anaerob) zu gewinnen und bis zur Messung aufzubewahren ist, die so genannte Prä-Analytik: Eine Änderung der Temperatur, des Säure-Basen-Status (CO2-Verlust mit Alkalisierung) oder der O2-Sättigung (Luftkontakt) sind auszuschließen. Hier müssen die Hersteller von Gerinnungs-Diagnostika aktuell erheblich nachbessern [1].
- Von Ausnahmen abgesehen, bezieht sich die Diagnostik (wie auch die physiologische Regulation) auf das Plasma als Teil des extrazellulären Flüssigkeitsvolumens (ECFV), d. h., alle Größen werden auf Plasma bezogen. Beispiele sind Glukose und Lactat, weil diese Metabolite infolge sehr unterschiedlicher Verteilung zwischen Plasma und Erythrozyten (ICFV) nicht im Vollblut gemessen werden sollten. Eine typische Vollblut-Ausnahme ist die plasmatische plus zelluläre Gerinnungs-Diagnostik. Aber auch hier gilt das Credo: POC zielt auf das aktuelle Plasma bzw. Vollblut des Patienten in vivo.
- Schließlich gilt das Prinzip der Diagnostik "aktuelle Werte des Patienten in vivo" natürlich auch für Bereiche der Therapie, wie mit Beispielen belegt werden wird.
Beispiele für POC in vivo
⇒ Ionisiertes Calcium (cCa2+)
Hier stehen der aktuelle sowie der auf pH 7,4 korrigierte Wert zur Verfügung, letzterer normiert cCa2+, d. h., eliminiert den Einfluss des pH auf cCa2+ (Azidose hebt, Alkalose senkt cCa2+). Weil aber auch eine Erhöhung der Lactat-Konzentration cCa2+ senkt, lässt sich bei Intensivpatienten zeigen, dass sich beide Effekte weitgehend aufheben können. Soll also die für Polytrauma-Patienten typische Hypocalcämie mit resultierender Gerinnungs-Störung diagnostiziert werden, kann nur die aktuelle In-vivo-Ca2+-Diagnostik in Betracht kommen.
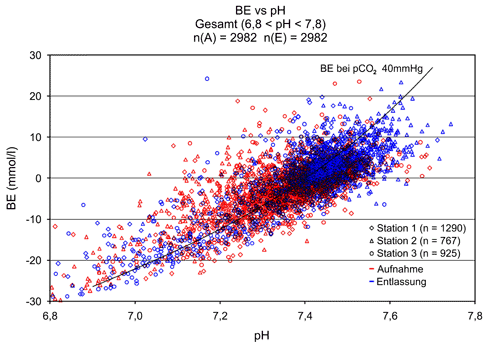
Die folgende Abbildung zeigt das Ausmaß der pH-Variation bei Intensivpatienten [6]: Fast 3.000 Patienten von 3 Intensivstationen bei Aufnahme und "Entlassung" (incl. Verstorbene) zeigen BE-Werte von -30 bis +30 mmol/l und CO2-Partialdrücke (nur indirekt dargestellt) von 15 bis 120 mmHg (die Funktion gilt für einen pCO2 von 40 mmHg).
⇒ Hypothermie
- Beatmung
Ein Patient mit einer Körpertemperatur von z. B. 27 °C muss richtig beatmet werden. Im Blutgas-Analysator wird die Blutprobe mit einem hier angenommenen BE von 0 mmol/l bei 37 °C gemessen. Trotz richtiger Beatmung, unter Kontrolle des Kapnometers auf pCO2 40 mmHg, zeigt das Gerät jetzt einen verwirrenden Wert von 70 mmHg (Abnahme der CO2-Löslichkeit vom Patient zum Gerät) und, daraus resultierend, einen Methoden bedingten pH von nur noch 7,25.
Empfehlung: Die Patienten-Temperatur von 27 °C am Gerät eingeben, damit der Arzt nun verständliche Werte erhält, nämlich die auf die Patienten-Temperatur in vivo korrigierten Werte, jetzt pCO2 40 mmHg und pH 7,40 [4]. Entscheidend ist auch hier wieder die In-vivo-Situation des Patienten! - Ionisiertes Calcium
Dieser Methoden bedingte saure pH erhöht das cCa2+ irrtümlich, also wäre es falsch, das auf pH 7,40 korrigierte cCa2+ zu verwenden. Hier könnte vorläufig nur gelten, die Probe bei 27 °C zu messen, oder das aktuelle In-vivo-Ca2+ korrigiert auf die Patienten-Temperatur zu verwenden. - Gerinnungstests
Wird beim Gerinnungstest eine Mess-Temperatur von 37 °C vorgeben, wird für den Patienten mit 27 °C eine normale Gerinnung diagnostiziert, obwohl er Hypothermie bedingt stark blutet. Hier müsste das Gerät, was heute möglich ist, auf 27 °C eingestellt werden, damit die Gerinnungs-Diagnostik lege artis für seine In-Vivo-Situation erfolgen kann [1].
Cave: Es ist zu befürchten, dass die Befunde zur Temperatur-Abhängigkeit der Gerinnung teilweise darauf zurückzuführen sind, dass bei der 37 °C-Messung eine Azidose erzeugt wird, die schon für sich allein eine Gerinnungs-Hemmung verursacht.
⇒ Patient mit Azidose (BE -15 mmol/l)
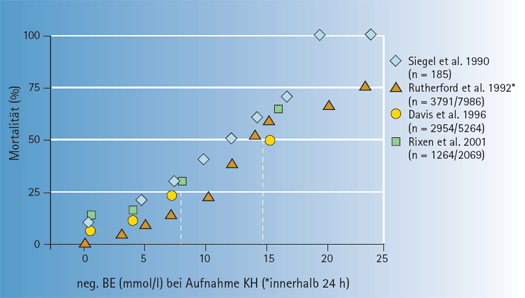
Unbestritten ist der Base Excess heute für Polytrauma-Patienten neben dem Quick-Wert (s. u.) der wichtigste Prognose-Indikator für das spätere Überleben. Die Fakten von ~ 8.200 Polytrauma-Patienten aus 4 Studien (siehe folgende Abbildung) sprechen für sich, über 50 % dieser Patienten versterben an der unstillbaren Blutung [3].
- Gerinnungs-Diagnostik mit gepufferten oder ungepufferten Reagenzien
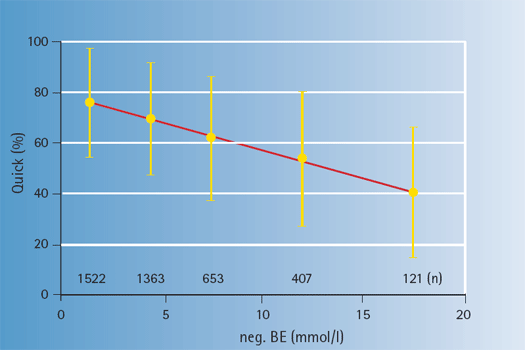
Je nachdem, welche Reagenzien für einen einfachen Quick-Test (Prothrombinzeit) eingesetzt werden, wird für den Azidose bedingt blutenden Patienten ein normaler Wert (~ 100 %) angezeigt, wenn gepufferte Reagenzien (Roche) verwendet werden, oder ein Quick von nur ~ 50 %, wenn ungepufferte Reagenzien (Dade Behring) zum Einsatz kommen. Selbst wenn nicht zu klären ist, welche Reagenzien zum Einsatz gekommen sind, zeigt sich der Effekt des Base Excess (BE) auf den Quickwert (PT) sehr deutlich: Negativer BE und Quick korrelieren hochsignifikant bei ~ 4.000 Polytrauma-Patienten (siehe folgende Abbildung, Traumaregister der Deutschen Gesellschaft für Unfallchirurgie) [1, 3, 5].
- Die logische Konsequenz: Eine optimale Diagnostik für den Patienten in vivo erfordert ungepufferte Reagenzien. Hersteller, die immer noch für gepufferte Reagenzien plädieren (z. B. Roche, Multiplate Group), sollten offen legen, auf welchen pH ihre Reagenzien gepuffert werden, um die Vergleichbarkeit mit anderen Verfahren sicherzustellen. Dies gilt natürlich für alle Verfahren der Gerinnungs-Diagnostik und damit auch für die mit Vollblut arbeitenden Geräte wie TEG 5000 (Haemonetics), Multiplate (Multiplate Group, Instrumentation Laboratory), PFA-100 (Siemens) und Rotem (Pentapharm), um einige Beispiele zu nennen.
Cave: Es ist zu befürchten, dass die Verwendung gepufferter Reagenzien ohne eine Deklarierung des pH-Wertes eine fatale Fehl-Diagnose deshalb erzeugt, weil pH-Werte unter 7,40 eine Hemmung und solche über 7,40 eine Steigerung der Gerinnung bedingen. - Base Excess in vivo
Der Base Excess (BE) wird aus den Messwerten pH, pCO2, cHb und sO2 der Blutprobe berechnet. Die Einbeziehung der O2-Sättigung (sO2) hat nicht nur Vorteile bei der Probengewinnung (jede arterielle, venöse oder gemischt-venöse Probe kommt zum Einsatz), sondern gewährleistet auch dann eine optimale Diagnostik, wenn sich wie in der Neonatologie die sO2 bis auf angenähert 0 % vermindert. Also eine optimale In-vivo-Diagnostik, nicht nur für den Feten. - Potentieller Base Excess
Wenn es darum geht, Infusionslösungen zu deklarieren, ob sie beim Patienten in vivo einen Einfluss auf den Säure-Basen-Status ausüben oder nicht, wird heute von drei deutschen Anbietern von Infusionslösungen der BEpot verwendet: Er beschreibt die potentielle Wirkung dieser Lösung auf den In-vivo-SB-Status des Patienten. Eine bikarbonatfreie Lösung mit einem Zusatz von 24 mmol/l Azetat wird danach mit einem BEpot von 0 mmol/l deklariert, weil sie nach Umwandlung von Azetat in HCO3 in vivo keinen Einfluss auf den SB-Status ausüben kann [2].
⇒ Osmolalität
- Berechnung im Blutgas-Analysator
Die Berechnung der Osmolalität erfolgt in einem Blutgas-Analysator anhand von Messwerten (z. B. Natrium, Kalium, Glukose, Harnstoff) für das Plasma, wobei hier ausnahmsweise statt der Einheit für die Osmolarität (mosmol/l) die der Osmolalität (mosmol/kg H2O) gewählt wird. Dies ist erforderlich, weil sich das Plasma (extrazellulär) dann im Gleichgewicht mit dem Gewebe (intrazellulär) befindet, wenn die Osmolalitäten - streng reguliert - und nicht die Osmolaritäten gleich sind. Auch hier gilt der Grundsatz in vivo. - Deklarierung einer Infusionslösung
Wenn heute die 5 %ige Glukose-Lösung immer noch als isoton deklariert wird, weil dies als Messwert (Gefrierpunktsdepression) im Labor in vitro erhalten wird, dann suggeriert dies dem Arzt ein grob falsches Vorgehen, weil mit dieser Lösung, nach schneller Metabolisierung der Glukose in vivo, eigentlich Aqua dest. infundiert wird. Die Forderung muss daher lauten, diese Lösung mit einer Osmolalität von 0 mosmol/kg H2O für die In-vivo-Situation zu deklarieren. Eine bikarbonatfreie Lösung mit einem Zusatz von 24 mmol/l Azetat kann nur mit einer In-vivo-Osmolalität deklariert werden, um die In-vivo-Situation nach Infusion und Umwandlung von Azetat in HCO3 zu beschreiben [2].
Fazit
Die Point of Care Diagnostik hat zum Ziel, die aktuellen In-vivo-Befunde des Patienten zu erheben, um daraus die erforderliche In-vivo-Therapie abzuleiten. Dieses Credo sollte auch für die Gerinnungs-Diagnostik übernommen werden, was derzeit dringend erforderlich erscheint. Eine normierte In-vitro-Diagnostik des Zentrallabors kann diese Forderungen nur teilweise erfüllen. Nur eine In-vivo-Diagnostik der aktuellen Situation des Patienten eröffnet somit die Möglichkeit, eine gezielte In-vivo-Therapie des Elektrolyt-, Säure-Basen-, Metabolit- und Gerinnungs-Status zu gewährleisten. Insbesondere die Gerinnungs-Therapeutika sind hiervon tangiert, weil sie vielfach über längere Zeit mit einer optimalen Diagnostik einzustellen sind. Für den Einsatz von Infusionslösungen wird die gleiche Forderung bereits praktiziert:
In vivo als Ziel für Diagnostik plus Therapie!
Literatur
- 10/2009: QualiTest Heft 11: Appell Gerinnungsdiagnostik
- 07/2009: Deklarierung von Infusionslösungen: Osmolalität und BEpot in vivo
- 07/2008: Größere Blutung - Azidose verhindern !
- 10/2007: Empfehlungen zur Diagnostik unter Hypothermie
- 09/2006: Base Excess und Gerinnung
- F. Lodde: Störungen des Elektrolyt-, Säure-Basen- und Metabolit-Status von Intensivpatienten (Med. Dissertation Mainz, in Vorbereitung)
