
Trinken: Isotone Flüssigkeiten – Wasservergiftung
Vorbemerkung: Dieser Beitrag ist für Mediziner aber auch medizinische Laien geeignet, die Anhänge sind vornehmlich für Mediziner gedacht.
Autoren
- Univ.-Prof. Dr. med. Rolf Zander, Physioklin Mainz
- Univ.-Prof. Dr. med. Ralph Kettritz, FASN
Medizinische Klinik mit Schwerpunkt Nephrologie und Internistische Intensivmedizin
Charité - Universitätsmedizin Berlin und
Experimental and Clinical Research Center
Berlin, Germany
Die Beiträge von Herrn Kettritz werden als Kommentare (KK) gekennzeichnet.
Empfehlungen für Mediziner und Laien zum Trinken von Flüssigkeiten
- Empfehlungen für sogenannte isotone Flüssigkeiten – von wem auch immer – sind wertlos, sie nützen nur dem Kommerz oder einer Institution.
- Für den täglichen Gebrauch ist Leitungswasser mit seinen wenigen Elektrolyten zur Flüssigkeitszufuhr geeignet, sei es in Form von Kaffee, Tee oder Fruchtsaft-Schorle.
Das gleiche gilt für Mineralwasser, Bier und Wein, unabhängig vom Alkohol
Alle genannten Flüssigkeiten enthalten neben den geringen Elektrolyt-Konzentrationen 75 bis 80 % freies Wasser, das in wenigen Stunden ausgeschieden wird. - Zufuhr übergroßer Mengen an Flüssigkeit, also wenige Liter in wenigen Stunden, bergen die Gefahr einer Wasservergiftung. Diese bewirkt im Organismus einen Abfall der Natrium-Konzentration (Hyponatriämie) mit der Folge einer sehr gefährlichen Hirn-Schwellung (Ödem).
- Für sportliche Aktivitäten gelten die gleichen Regeln, allerdings mit dem Hinweis, keine übergroßen Mengen an Flüssigkeit – ohne Durst – zu trinken.
Hintergrund
Der Flüssigkeitshaushalt ist eine spannende Geschichte, die von uns täglich beeinflusst werden kann. Sowohl die tägliche Aufnahme, von uns beeinflusst, als auch die automatische Ausscheidung über die Nieren, von uns kaum beeinflussbar, wird alles vom Organismus geregelt.
Diese sogenannte Osmoregulation hat zum Ziel, osmotische Gradienten über alle Zellmembranen zu verhindern, da es ansonsten zum Schwellen oder Schrumpfen von Zellen kommt. Schwellung von Hirnzellen führt zum Hirnödem und Schrumpfen zu intrakraniellen Blutungen. Beide lebensgefährlichen Zustände müssen vermieden werden.
Eine lebensbedrohliche Situation kann dann entstehen, wenn die Natrium-Konzentration im Blut-Plasma nach unten vom Normalwert abweicht, eine Hyponatriämie: Entweder wurde zu viel Flüssigkeit zugeführt, oral vom Patienten oder intravenös vom Arzt, oder die Nieren waren nicht in der Lage genug (freies) Wasser auszuscheiden.
Osmotischer Druck
Würde menschliches Plasma bei 37 °C in eine mechanisch stabile sog. Pfeffersche Zelle gefüllt, nur durch eine semipermeable, also nur für Wasser durchlässige Membran vom umgebenden Wasser getrennt, dann würde der hydrostatische Druck im Steigrohr bis auf 76 m Höhe ansteigen, das entspräche einem Haus mit 25 Stockwerken.
Fazit
Der osmotische Druck ist eine immense Kraft, die es zu regeln gilt (Anhang osmotischer Druck).
Osmolalität
(Anhang Osmolalität - Theorie vs. klin. Praxis)
In der Medizin wird der osmotische Druck einer Flüssigkeit mit der Osmolalität charakterisiert, angegeben in mosmol/kg H2O. Das hat folgenden Grund (Zitat 2015):
Das osmotische Gleichgewicht zwischen den verschiedenen Kompartimenten des Organismus ist dann gegeben, wenn die Anzahl der osmotisch wirksamen Teilchen (Osmole) im zur Verfügung stehenden Wasserraum ausgeglichen ist. Beispielsweise steht die frei permeable Glukose dann zwischen Erythrozyt (Wassergehalt 71 %) und Plasma (Wassergehalt 94 %) im Gleichgewicht, wenn die Konzentrationen im zur Verfügung stehenden Wasserraum (l ≈ kg H2O) gleich sind. Daher ist der Bezug auf ein Kilogramm Wasser, also Osmolalität (mosmol/kg H2O) physiologisch zwingend.
Tatsächlich wurde durch Messung experimentell belegt, dass die Osmolalität aller Körperflüssigkeiten einschließlich Erythrozyten in keinem Falle eine Abweichung von mehr als 1 mosmol/kg H2O vom Plasmawert aufweist (288 mosmol/kg H2O). Hat eine Lösung den gleichen osmotischen Druck wie das Zellinnere, ist sie isoosmotisch und erzeugt an der nur für Wasser durchlässigen (näherungsweise semipermeablen) Zellmembran keine Wasser-Diffusion – weder hinein noch hinaus – und damit keine hydrostatische Druckdifferenz.
Isotonie
Die Isotonie kann man beschreiben als iso-osmotisch bzw. iso-osmolal, entsprechende Flüssigkeiten werden dann vereinfacht als isoton bezeichnet. Bereits 2015 wurde die Isotonie in Physioklin als Gemeinsamkeit von Muttermilch, Kokosmilch, alkoholfreiem Bier, Bitburger Sportgetränken, Erdinger alkoholfrei und Infusionslösungen beschrieben, dies ist in der Zwischenzeit allerdings in einigen Fällen revisionsbedürftig.
Neue (2023) externe Definition „Isotone Flüssigkeiten“
Da „Isotone Flüssigkeiten“ in der Werbung einen extrem breiten Raum einnehmen, wurde versucht, aus der Vielzahl der Angaben im Internet, der Werbung, von Institutionen oder Fachgesellschaften eine Definition isotoner Flüssigkeiten zu erhalten.
Dazu wurden folgende exemplarische Anfragen gestartet.
- DGE (Deutsche Gesellschaft für Ernährung e.V. Bonn):
Wir haben dazu keine Publikation, unsere Leitlinien beziehen sich auf Protein, Kohlenhydrate und Fett (Referat Öffentlichkeitsarbeit). - DSHS Köln (Deutsche Sporthochschule Köln):
Antwort nur Übermittlung von Literatur: Sport Nutrition Department, Institute of Biochemistry, German Research Centre of Elite Sport, German Sport University Cologne Mosler S, Braun H, Carlsohn A et al.: Flüssigkeitsmanagement im Sport, Position der Arbeitsgruppe Sporternährung der Deutschen Gesellschaft für Ernährung e. V. (DGE), Ernaehrungs Umschau international 3/2019: 66: 52–59.
Die in Tab. 2 genannten Empfehlungen für die Nährstoffgehalte in einem isotonen Rehydratationsgetränk (Brouns et al. 1992) sind als Spanne wenig hilfreich bzw. abwegig (z. B. Natrium 17 - 48 mmol/l) oder falsch: Osmolalität < 300 mmol/kg. - ÖkoTest
Keine Antwort auf eine Anfrage bei Redaktion@oekotest.de zum Test 2023 „Isotonische Getränke im Test“ mit der Bitte um die Definition der Isotonie (Anhang Apfelsaft-Schorle). - Bierbrauerei Bitburger
Keine Antwort nach E-Mail-Verkehr mit diversen Anmerkungen erhalten.
- Die Osmolalität kann bei fehlenden Anionen durch Verdoppelung der bekannten Kationen (Na, K, Mg, Ca) erhalten werden; helles Bier hat mit 40 mosmol/kg H2O eindeutig eine geringere Osmolalität als Leitungswasser mit 61 mosmol/kg H2O).
- Wenn Flüssigkeiten als isoton bezeichnet werden, dann darf nur die „in vivo-Isotonie“ (Proband) verwendet werden, nicht die „in vitro–Isotonie“ (Labor), weil Kohlenhydrate (z. B. Glucose) im Organismus sehr schnell metabolisiert werden.
Die Firma Bitburger besteht auf der Formulierung vom 07.11.2023: Dass unser Bitburger 0,0% weiterhin isotonisch ist, steht außer Frage (Anhang Apfelsaft-Schorle).
Klinik einer Hyponatriämie
KK Eine retrospektive Kohortenstudie (Lu et al. 2020) von 2012 bis 2018 zeigt anhand von 6.539 Krankenhausaufenthalten aus der Schweiz eine Assoziation – keine Kausalität – von Hyponatriämie und Mortalität. Hyponatriämie, die häufigste Elektrolytanomalie bei Krankenhauspatienten, wird meistens als Serum-Na £135 mmol/l definiert. Die Daten weisen darauf hin, dass eine Hyponatriämie bei Patienten, die in ein Krankenhaus aufgenommen werden, nicht nur häufig ist, sondern sogar häufig erst im Krankenhaus entsteht. Die erhöhte Mortalität ist sicherlich multifaktoriell, aber dass schwere Hyponatriämien zu Hirnödem, auch mit tödlichem Ausgang, führen können, ist gut dokumentiert. Experten definieren eine schwere Hyponatriämie meistens als Serum-Na <125 oder <120 mmol/l und weisen darauf hin, dass bei diesen Patienten schnelles Handeln notwendig ist, sobald moderat-schwere oder schwere Symptome des Hirndrucks auftreten. Hierzu zählen: Übelkeit mit und ohne Erbrechen, Kopfschmerzen, Verwirrung, Somnolenz, Koma und kardiorespiratorische Symptome. KK
Nach Funk et al. 2010 korreliert die Natrium-Konzentration bei ICU-Aufnahme mit der Mortalität von 151.486 Patienten in Österreich, gesammelt von 1998 - 2007 in 77 med. / chirurg. Intensivstationen. Danach verstarben / versterben in Österreich von über 150.000 Patienten jedes Jahr im Krankenhaus insgesamt 609 Patienten vermutlich an einem Hirnödem infolge Hypo-Osmolalität bei Hypo-Natriämie (609 Pat. p.a.: Na 118, 1,2 %, Mortalität 33 %, 60 p.a.; Na 128, 2,7 %, Mortalität 32 %, 131 p.a.; Na 132, 13,8 %, Mortalität 20 %, 418 p.a.).
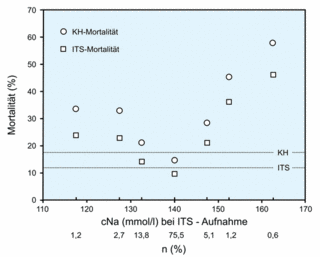
Anmerkung ...
... zum Normalwert der Natrium-Konzentration (Serum oder Plasma)
In den hier zitierten Publikationen (einschließlich Anhänge) findet sich keine konkrete Angabe zum Normalwert der Natrium-Konzentration, wie folgende Beispiele zeigen (mmol/l):
Worthley et al. (1987) 138 ± 1,93 (n = 100)
Funk et al. (2010) 135 - 145 (n = 114.170)
Fazekas et al. (2013) 143 ± 1,3 (n = 41)
Lu et al. (2020) >135 (n = 6.539)
Der Normalwert wird bis auf Weiteres mit einer Spanne von 138 - 143 mmol/l angenommen, diese Werte können dann für weitere Berechnungen (Osmolaliät, osmolale Lücke) verwendet werden.
Wasser-Vergiftung
DGE
Unter normalen Trinkgewohnheiten ist mit einer zu hohen Wasseraufnahme nicht zu rechnen, da die Fähigkeit zur Ausscheidung von Wasser für den Erwachsenen bei kurzzeitiger Belastung fast 1 l /Stunde beträgt (Leitung Referat Öffentlichkeitsarbeit).
Quelle: Deutsche Gesellschaft für Ernährung, Österreichische Gesellschaft für Ernährung, Schweizerische Gesellschaft für Ernährung (Hrsg.): Wasser. In: Referenzwerte für die Nährstoffzufuhr. Bonn, 2. Auflage, Ausgabe (1. Ausgabe 2015).
Theoretische Vorhersage
Wenn ein Mensch mit 75 kg Körpergewicht und seinem üblichem 15 Liter extracellulären Flüssigkeitsvolumen (ECV) und 30 Liter intracellulärem (ICV) Wasservolumen in kurzer Zeit 2 Liter reines Wasser trinkt, dann ergibt dies eine Körpergewichts-Zunahme um 2 kg. Diese harmlose Zunahme verteilt sich zu 1/3 auf das ECV (also dann 15,66 kg) und 2/3 auf das ICV (also 31,33 kg): 15 x 142 = 15,66 x 136.
Scheinbar harmlos würde die Messung der Natrium-Konzentration des Plasmas mit 136 statt 142 mmol/l ausfallen (oder 134 statt 140), eine scheinbar klinisch harmlose Hypo-Natriämie, weil sich das Natrium nur im vergleichsweise kleinen ECV verteilt.
Die Osmolalität aber vermindert sich von 288 auf 276 mosmol/kg H2O in beiden Räumen um gut 4 % oder 12 mosmol/kg H2O, allerdings nur solange das Wasser nicht über die Nieren ausgeschieden werden kann: 45 x 288 = 47 x 276.
Diese scheinbar harmlose Hypo-Osmolalität erzeugt aber im Schädel bei (37 °C) einen Druck von 328 mmHg, also ein Hirnödem, das natürlich sofort über eine Volumenverschiebung von Gehirnflüssigkeit (Liquor) und Blut ausgeglichen werden muss.
Klinische Praxis vs. Theoretische Vorhersage
Die theoretische Vorhersage stimmt nur insofern mit der klinischen Praxis überein, als eine Hyponatriämie von 136 mmol/l als noch harmlos eingestuft wird: Nach Lu et al. (2020) beginnt die relative Hyponatriämie erst bei 135 mmol/l oder darunter (<135 mmol/l).

Da die Wasservergiftung offensichtlich großes Interesse findet, wurden willkürlich ausgewählte Daten im Internet zusammengetragen (Anhang Wasservergiftung - Internet).
Isotone Flüssigkeiten
Flüssigkeiten werden dann vereinfacht als isoton bezeichnet, wenn sie die gleiche Osmolalität wie menschliches Plasma von 288 mosmol/kg H2O aufweisen.
Von den 2015 in Physioklin zurecht als isoton bezeichneten Flüssigkeiten, nämlich Muttermilch und Kokosmilch, müssen hier alkoholfreies Bier (Bitburger) und sog. Sportgetränke sowie Instituts-Empfehlungen einer neuen Prüfung unterzogen werden.
Eine isotone Flüssigkeit, auch als iso-osmotisch bzw. iso-osmolal bezeichnet, sollte die gleiche Osmolalität wie das menschliche Plasma besitzen.
Um dem Leser die Lektüre zu vereinfachen, wird im Folgenden der Anteil des freien Wassers beschrieben: Eine Flüssigkeit mit diesem theoretischen Wert (288) wird hier mit 0 % freies Wasser beschrieben, eine Flüssigkeit wie reines Wasser (Aqua dest.) dann entsprechend mit 100 % freies Wasser. Im Folgenden dann abgekürzt mit 0 bzw. 100 % fW.
Freies Wasser (% fW ) nicht verwechseln mit Wassergehalt (%)
Diese vorerst theoretische Beschreibung kann aber mit einfachen praktischen Fakten interpretiert werden: Hat eine Flüssigkeit einen Wert von 50 % fW, dann wird die eine Hälfte (freies Wasser) sehr schnell in wenigen Stunden ausgeschieden, die andere Hälfte (in vivo isoton) kann erst nach mehreren Tagen vollständig ausgeschieden werden (Anhang Ausscheidungskinetik).
Freies Wasser wird in Stunden, isotone Flüssigkeit in Tagen ausgeschieden
Beispiele:
- 0,9 % NaCl, die klassische sog. physiologische Kochsalzlösung der Medizin enthält mit 286 statt 288 mosmol/kg H2O nur 0,7 % fW und wird daher „noch“ als isoton bezeichnet.
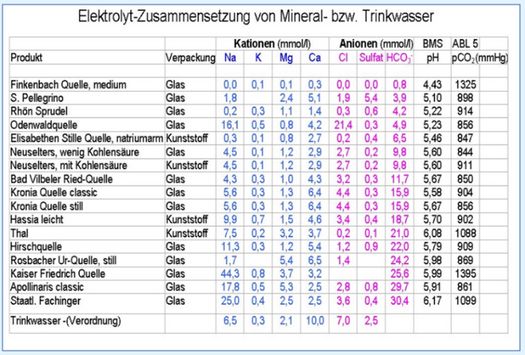
- Staatlich Fachinger, das Mineralwasser mit der höchsten Elektrolyt-Konzentration, enthält laut Tabelle an Mineralien 35,4 mosmol/l Kationen und 34,8 mmol/l Anionen (Ionen-Neutralität praktisch erreicht), also eine Osmolarität von 70 mmol/l (Ionen-Äquivalente) und eine Osmolalität von 65 mosmol/kg H2O (Umrechnungsfaktor 0,929). Das entspricht einem Gehalt an freiem Wasser von 77 % fW (288 - 65 = 223 x 100 / 288 = 77 %).

Isotonie in vivo (Patient)
In der Tabelle ist eine, in der Medizin benutzte, 5 %ige Glukose-Lösung aufgeführt, die folgender Erklärung bedarf:
Das Verhalten der Osmolalitäts-Messung im Labor "in vitro" kann sich von der wichtigen Wirkung im Patienten "in vivo" unterscheiden. Als Beispiel dafür gilt die 5 %ige Glukose-Lösung, die in vitro eindeutig isoton ist (290 mosmol/kg H2O), in vivo aber wie Aqua dest. extrem hypoton wirkt, weil die Glukose im Organismus schnell metabolisiert wird. Sie wird z.B. dazu verwendet, um freies Wasser bei Patienten mit Hypernatriämie (Exsikkose) zu substituieren.
Wenn (orale) Flüssigkeiten als isoton bezeichnet werden, dann darf nur die „in vivo-Isotonie“ verwendet werden.
Daraus ergeben sich für den täglichen Gebrauch erhebliche Konsequenzen.
Klassische Getränke
Vorbemerkung: Wenn die Osmolarität in mosmol/l (daraus dann Osmolalität) aus der Elektrolyt-Zusammensetzung entwickelt werden soll, dann kann die Summe der bekannten Kationen (Na, K, Mg, Ca) unter Berücksichtigung ihrer Wertigkeit als Milli-Osmole für die fehlenden Anionen verdoppelt werden, um so vereinfacht – elektroneutral – alle positiv und negativ geladenen Milli-Osmole zu addieren.
- Leitungswasser
Enthält nach der (alten) Trinkwasserverordnung (s. Tabelle) 33 Mini-Äquivalente an Kationen (Na, K, Mg, Ca) und damit plus Anionen (Chlorid, Sulfat, Carbonat, Bikarbonat, Nitrat etc.) infolge Elektroneutralität eine Osmolalität von 66 mosmol/l bzw. 61 mosmol/kg H2O. Das freie Wasser beträgt dann 79 % fW.
- Kaffee oder Tee
Da diese Getränke mit Leitungswasser zubereitet werden, weisen sie den gleichen Wassergehalt wie Leitungswasser von 79 % fW auf (s. Tabelle). Wird der Kaffee oder Tee gesüßt, ändert das nichts am Anteil freien Wassers (in vivo-Osmolalität), wenn die Glukose beim Nichtdiabetiker in die Zellen verschoben wird.
- Bier (hell)
Wasser 90 %. Elektrolyte (mosmol/l): Na 2,2; K 9,7; Mg (x 2) 7,6; Ca (x 2) 2,0 = 21,5 = 43 mosmol/l = 40 mosmol/kg H2O, fW = 86 %.
- Wein (weiß)
Wasser 89 %. Na 0,9; K 21; Mg (x 2) 8,4; Ca (x 2) 4,6 = 35 = 70 mosmol/l = 65 mosmol/kg H2O, fW = 77 %.
- Apfelsaft
Wasser 88 %. Elektrolyte (mosmol/l): Na 1; K 30; Mg (x 2) 3,6; Ca (x 2) 3,6 = 38,2 = 76,4 mosmol/l = 71 mosmol/kg H2O, fW = 75 %.
Zusammensetzung von Apfelsaft, Bier und Wein nach Souci SC, Fachmann W, Kraut H: Die Zusammensetzung der Lebensmittel (5. Aufl.). Medpharm, Stuttgart 1994.
- Apfelsaft-Schorle
Das Beispiel der – pausenlos empfohlenen – Apfelsaft-Schorle wird wie folgt beschrieben, hier z. B. Staatlich Fachinger (1 + 1) 1:2 verdünnt mit Apfelsaft (nach DOSB):
Apfelsaft Osmolalität 71 mosmol/kg H2O
Staatlich Fachinger Osmolarität 65 mosmol/kg H2O.
Apfelsaft-Schorle mit Staatl. Fachinger 1 + 1 = 68 mosmol/kg H2O.
Freies Wasser 76 % fW.
Literatur
Brouns F, Saris WHM, Schneider H:
Rationsale for upper limits of electrolyte replacement during exercise
Int J Sport Nutr 1992; 2: 229-238
Fazekas AS, Funk GC, Klobassa DS, Rüther H, Ziegler I, Zander R, Semmelrock HJ:
Evaluation of 36 formulas for calculating plasma osmolality
Intensive Care Med 2013; 39: 302-308
Funk G-C, Lindner G, Druml W et al.:
Incidence and prognosis of dysnatremias present on ICU admission.
Intensive Care Med 2010; 36: 304-311
Lu H, Vollenweider P, Kissling S and Marques-Vidal P:
Prevalence and Description of Hyponatremia in a Swiss Tertiary Care Hospital: An Observational Retrospective Study.
Front Med (Lausanne) 2020; 7: 512
Worthley LI, Guerin M, Pain RW:
For calculating osmolality, the simplest formula is the best.
Anaesth Intensive Care 1987; 5:199 - 202
