
Detektion des Volumenmangels: Titration des ZVD
Fragestellung
Es fehlt eine klinisch akzeptable Methode der Blutvolumen-Bestimmung und damit die Detektion eines intravasalen Volumen-Mangels (volume deficiency). Ein solcher wird wohlklingend, aber unpräzise, nach Gabe eines Volumenbolus mit volume responsiveness (Empfänglichkeit) oder volume reagibility (Reaktionsfähigkeit) umschrieben.
Das Ergebnis einer vermeintlich erfolgreichen Volumengabe wird dann hämodynamische Stabilisierung, Verbesserung der Hämodynamik oder Resuscitation o. ä. genannt. Im aktuellen 6S Trial, ein so genannter „pragmatic trial“, heißt es dann zur Indikation einer Volumentherapie, nur noch lapidar “patients who need fluid resuscitation” [14].
Es besteht weitgehend Einigkeit, dass dynamische Parameter zur Detektion eines Volumenmangels den statischen überlegen sind. Es besteht keine Einigkeit, ob dynamische Fluss-Parameter im Hochdrucksystem nach dem Herzen den dynamischen Druck-Parametern im Niederdrucksystem vor dem Herzen vorzuziehen sind. Tatsache aber ist, dass die physiologische Volumenregulation, primär extravasal bzw. extrazellulär (ECFV und sekundär intravasal (IVFV), über Volumen-Rezeptoren im Niederdrucksystem vor dem Herzen, und die Druckregulation über Druck-Rezeptoren auf der Hochdruckseite nach dem Herzen erfolgt.
Hypothese
Zur Detektion eines Volumenmangels ist die kolloidale Titration des zentralen Venendruckes (ZVD), ein dynamischer Druck-Parameter im Niederdrucksystem vor dem Herzen, den dynamischen Fluss-Parametern im Hochdrucksystem nach dem Herzen überlegen.
Der Nachweis eines Mangels, von Minus nach Plus (vom Non-Responder zum Responder) auf der Druck-Volumen-Kurve, führt automatisch zu einem präziseren Ergebnis als von Plus nach Minus (Ende der responsiveness bzw. reagibility) auf der Frank-Starling-Kurve, was immer die Gefahr der Volumen-Überdosierung beinhaltet (vergleichbar dem Peter-Prinzip). Zitat von Jacob (München) auf dem DAC 2012 in Leipzig: „Maximal ist nicht gleich optimal“.
Regulation des Blutvolumens
An dieser Stelle soll nur in Erinnerung gebracht werden, dass die Regulation des ECFV erstens auf der Niederdruckseite und zweitens – im Vergleich zur Blutdruck-Regulation – langfristig erfolgt. Schließlich gibt es drittens keine spezifische Regulation für das eigentliche IVFV (Blutvolumen). Letzteres wird über das ECFV reguliert und dann erfolgt die Verteilung auf die beiden Räume vornehmlich über den kolloidosmotischen Druck (KOD). Das ECFV seinerseits wird dann über die renale Flüssigkeitsausscheidung, das Renin-Angiotensin-Aldosteron-System, das Adiuretin (Vasopressin) und die natriuretischen Peptide eingestellt. Diese große Zahl von Mechanismen zeigt die Vielfalt der Einflussmöglichkeiten auf das ECFV und damit erst sekundär auf das IVFV. Nach dem Herzen, also auf der Hochdruckseite, fehlen diese Mechanismen. Natürlich ist unbestritten, dass Änderungen des IVFV direkten Einfluss auf das Hochdrucksystem, also den Blutdruck ausüben.
Zentraler Venendruck (ZVD): Statisch
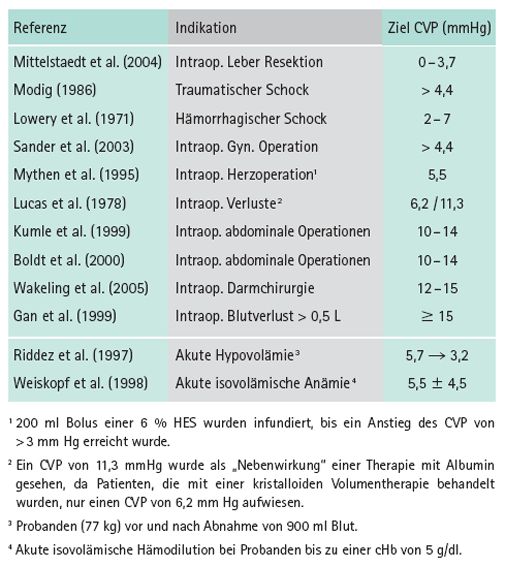
Am Beispiel des zentralen Venendruckes ZVD (CVP, mmHg), einer klassischen statischen Größe zur Beurteilung des Volumenstatus eines Patienten, wird demonstriert, wie unterschiedlich dieser Zielparameter eingesetzt wird. Dabei wird eine korrekte Messung unterstellt, nämlich richtige Katheter-Lage, kalibrierter Nullpunkt und Ausschaltung einer intrathorakalen (Beatmung, PEEP) oder intraabdominellen Druckerhöhung (z. B. Kompartmentsyndrom). Willkürlich ausgewählte Beispiele zum CVP (ZVD) enthält Tab. 1.
Im Vergleich zu den sehr niedrigen Normalwerten von 4 - 6 mmHg (5 - 8 cm H2O), die selbst unter akuter Hypovolämie und auch isovolämischer Hämodilution fast unverändert bleiben können, unterliegen die Zielwerte offensichtlich einer viel zu großen Variabilität, was als Unsicherheit der klinischen Kontrolle einer befürchteten Hypovolämie zu interpretieren sein dürfte.
Ein früherer Versuch [17], bei kritisch kranken Patienten unterschiedlichster Ätiologie mit über 1.500 Blutvolumen-Bestimmungen eine Korrelation zwischen CVP und Blutvolumen sowie HZV und MAP herzustellen, schlug fehl.
Die Ergebnisse werden mit folgenden Zitaten zusammengefasst:
- Eine Korrelation zwischen dem statischen CVP und dem zirkulierenden Blutvolumen hat niemals bestanden, allenfalls Extremwerte sind ein guter Indikator für den hämodynamischen Zustand eines Patienten [5].
- Der zentralvenöse Druck ist als Surrogatparameter für den Volumenstatus ungeeignet [6].
- Extrem niedrige CVP-Werte machen eine Hypovolämie und eine erniedrigte Vorlast zwar wahrscheinlich, hohe Werte schließen diese jedoch keinesfalls aus [20].
Tab. 1: Willkürlich ausgewählte Zielwerte des CVP (ZVD) bei entsprechenden Indikationen [aus Zander 2009, Literatur dort].
Fazit zum statischen CVP
Richtige Messung vorausgesetzt, kann für den CVP gelten: Ein Unterschreiten des Zielwerts (CVP <5 mmHg) belegt regelmäßig einen Volumenmangel, während das Erreichen des Zielwerts (CVP >10 mmHg) keine Gewähr für eine ausreichende Vorlast bietet [1].
Zentraler Venendruck (ZVD): Dynamisch (Titration des CVP)
Schon frühzeitig wurde erkannt, dass der statische Wert CVP auch dynamisch interpretiert werden kann: Eine Hypovolämie wird diagnostiziert, indem eine Antwort des CVP über eine Volumengabe provoziert wird, also eine Volumen-Titration des CVP so lange, bis dieser mit einem Druckanstieg antwortet. Der ursprüngliche Vorschlag allerdings [21], den CVP so lange mit 500 - 4.000 ml bis zum abrupten Anstieg des CVP zu titrieren, konnte nicht funktionieren, weil zur Titration kristalloide Lösungen eingesetzt wurden, die nur zu 20 % im Intravasalraum verbleiben (s.u.).
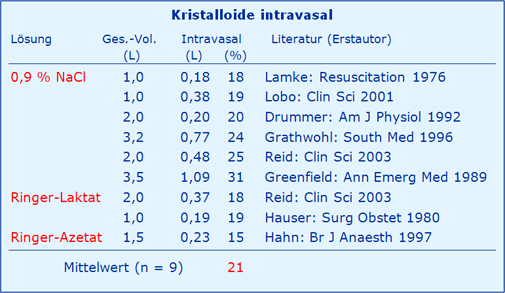
Diese 20 % leiten sich ab aus der Tatsache, dass beim Patienten 20 % des KG auf das extrazelluläre Flüssigkeitsvolumen (ECFV) entfallen, also 15 l (bei 75 kg KG), während auf das im ECFV enthaltene Plasmavolumen nur ca. 3 l entfallen (55 % von ca. 5 l intravasalem Blutvolumen IVFV). Bei gleichmäßiger Verteilung einer kristallinen Lösung werden somit 20 % intravasal (3/15) und 80 % extravasal (12/15) landen, wie mit Tab. 2 belegt.
Tab. 2: Literaturangaben über den intravasalen Verbleib von Kristalloiden [aus Zander 2009, Literatur dort].
In diesem Zusammenhang muss eine aktuelle Untersuchung erwähnt werden [7], in der die Volumenwirksamkeit von Ringer-Laktat quantitativ bestimmt wurde (Blut- und Plasmavolumen-Bestimmung mit Indocyaningrün). Das Ergebnis von 17 % Volumenwirksamkeit, also weniger als die erwarteten 20 %, ist darauf zurückzuführen, dass das hypotone Ringer-Laktat mit einer Osmolalität von nur 256 im Vergleich zu Plasma mit 288 mosmol/kg H2O einen Anteil von 12,5 % freien Wassers enthält (288/256 = 1,125) und die theoretische Volumenwirksamkeit somit nur 88,9 % (256 / 288 = 0,889) beträgt.
Nach Ausgleich der Osmolalitäten verschwindet dieses freie Wasser zu 2/3 im ICFV und damit erhöht sich die theoretische Volumenwirksamkeit von 88,9 auf 92,6 % und wird damit in vivo von 20 auf 18,5 % vermindert.
Vorschläge zur ZVD-Titration verwenden alle einen kolloidalen Volumenbolus von 200 - 250 ml (6 % HES oder 3,5 % GEL), der in ca. 10 min zum Anstieg des CVP von 2 - 3 mmHg führen soll (Responder), wenn kein Volumenmangel besteht [12, 13, 18, 19]. Besteht ein Volumenmangel, d. h. die Reaktion auf den Volumenbolus (Non-Responder) bleibt aus, ist diese Maßnahme so lange zu wiederholen, bis eine positive Antwort erfolgt (Responder). Ist der CVP-Anstieg größer als 5 mmHg, ist die Volumengabe zu stoppen [18].
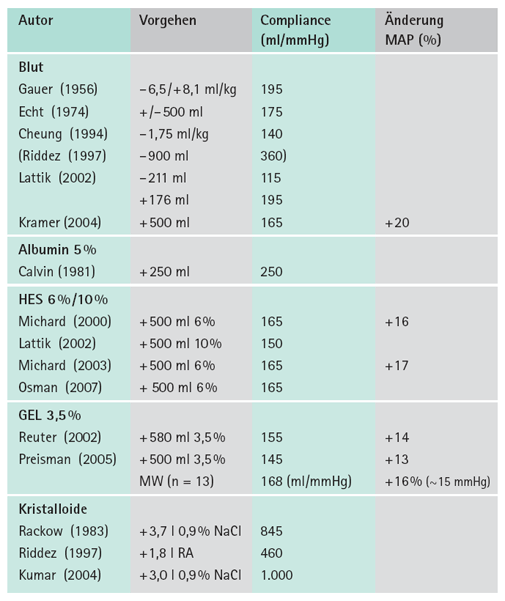
Genau genommen handelt es sich bei diesem Vorgehen um die Compliance-Bestimmung (∆V/∆P) des gesamten Niederdrucksystems. Tab. 3 zeigt die Ergebnisse derartiger Messungen am Menschen. Verwendet wurde Blut, Albumin 5 % und kolloidale Lösungen. Nach Elimination einer Ausnahme [16] liegen die Werte erstaunlich nah beieinander, der Mittelwert von 13 Literaturstellen beträgt danach 168 ml/mmHg. Erwartungsgemäß liegen die Werte bei Verwendung von kristalloiden Lösungen mit 450 - 1.000 ml/mmHg deutlich darüber, d. h. viel größere Volumina sind erforderlich, einen entsprechenden CVP-Anstieg zu provozieren.
Tab. 3: Messwerte der menschlichen Compliance des Niederdrucksystems (∆V/∆P, ml/mmHg), auf 5er-Schritte gerundet, also Änderung des CVP (mmHg) nach Volumen-Gabe oder -Entzug (ml) gemäß verschiedener Autoren. Wenn zwischen so genannten Respondern und Non-Respondern unterschieden wurde, wurden nur die Werte für die Responder verwendet [aus Zander 2009, Literatur dort].
Für die Titration des CVP, also dynamische Interpretation des CVP, kann daraus folgende Empfehlung abgeleitet werden: Zur Prüfung einer Hypovolämie wird ein Kolloid-Bolus von 500 ml (~ 3 x 168 ml) so oft appliziert, bis ein CVP-Anstieg von 3 mmHg provoziert werden kann. Dies entspricht in etwa den bereits erwähnten Vorschlägen beim Einsatz eines 200 - 250 ml Bolus, basiert aber auf einer großen Zahl von Messungen. „Challenging the intravascular compartment: Iteratively repeating a 200- to 500-ml fluid bolus in patients with oliguria, tachycardia, or hypotension." [10].
Aus Tabelle 3 kann aber auch abgelesen werden, dass ein Bolus von 168 ml Blut oder Kolloid einen Anstieg des MAP von ~15 mmHg verursacht, also eine Volumen-Titration des MAP. Wegen der deutlich kleineren Dehnbarkeit (Compliance, ∆V/∆P) des Hochdruck- im Vergleich zum Niederdrucksystem, muss der gleiche Bolus (∆V) im Hochdrucksystem zu einer deutlich größeren Druckantwort (∆P) führen.
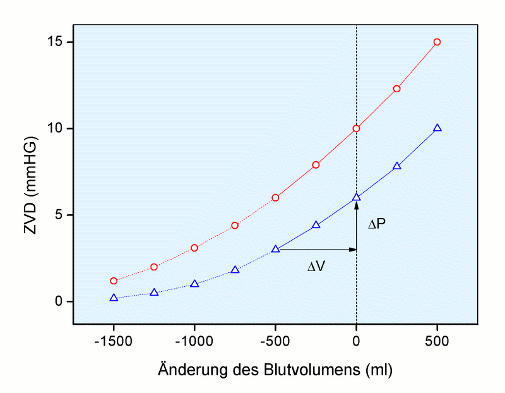
Die Titration des ZVD ist in der Abb. 1 dargestellt.
Abb. 1: Druck-Volumen-Diagramm des gesamten Niederdrucksystems: Die beiden Funktionen, normal (blau) und nach Gabe von Noradrenalin (rot), wurden nach den Daten von Echt et al. (1974) entwickelt, dargestellt bei Weyland et al. (2009) in Abb. 2. Die gestrichelten Teile kennzeichnen die extrapolierten Bereiche.
Es ist zu vermuten, dass die Titration von „wenig volumenreagibel“ zu „ gut volumenreagibel“, also von Nein (Non-Responder) zu Ja (Responder) wechselt, eine Aussage, die relativ scharf definiert ist.
Fazit zum dynamischen CVP
Zur Prüfung einer Hypovolämie (CVP <5 mm Hg) wird ein Kolloid-Bolus von 500 ml so oft appliziert, bis ein CVP-Anstieg von 3 mmHg provoziert werden kann. Dieses Verfahren ist weitgehend unabhängig von Fehlern bei der Bestimmung des CVP (Lage, Kalibration, Beatmung).
ZVD statisch oder dynamisch – Negativ-Beispiele
Zum besseren Verständnis sollen Negativ-Beispiele mit Kommentaren (K) zur Messung des statischen oder dynamischen CVP aufgeführt werden.
- In der VISEP-Studie wurde bereits vor der geplanten Volumentherapie des septischen Schocks in allen Patienten-Gruppen ein einheitlicher CVP von 12 mmHg registriert [3].
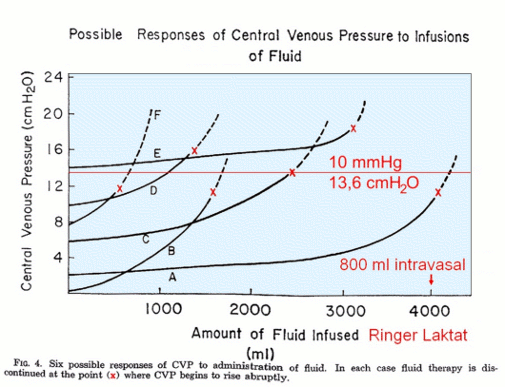
K: Ein offensichtlich supranormaler Wert verglichen mit den „hämodynamischen Zielvorgaben, wie zentraler Venendruck >8 mmHg“. - Titration des CVP bei Patienten (n = 123) im septischen Schock mit 500 - 4.000 ml Ringer-Laktat bis zum abrupten Anstieg desselben, dargestellt in Abb. 2.
K: Kristalloide Lösungen sind für die Titration des ZVD nicht geeignet, weil sie nur zu 20 % im IVFV verbleiben. Bei diesen großen Volumina besteht sogar die Gefahr eines Kompartmentsyndroms, das selbst einen ZVD-Anstieg verursachen kann. - Zitat Weyland (2009): Auch bei spontan atmenden Probanden, die in einer Untersuchung von Kumar et al. (2004) unter streng kontrollierten Bedingungen einer Volumenbelastung von 3.000 ml NaCl 0,9 % ausgesetzt wurden, zeigte sich, dass die Änderungen des ZVD keinen gerichteten Zusammenhang mit den resultierenden SVI-Änderungen aufwiesen (r = 0,22; p = 0,49).
K: Gleicher Kommentar wie unter 2.
Abb. 2.: Titration des CVP, entnommen und ergänzt aus [Wilson et al. 1967].
Dynamische Parameter nach dem Herzen
Dynamische Parameter nach dem Herzen gelten seit vielen Jahren als Methode der Wahl: „Dynamic parameters should be used preferentially to static parameters to predict fluid responsiveness in ICU patients." [11].
Dazu zählen z. B. die Optimierung dynamischer Größen wie das Schlag- oder das Herzzeit-Volumen anhand der Messung dynamischer Parameter wie Variation von Schlagvolumen (stroke volume variation, SVV) oder Pulsdruck (pulse pressure variation, PPV), oder respiratorische Schwankungen im Pulsdruck (Differenz im Pulsdruck, dPP) oder im Pulsoxymeter-Plethysmogramm. Zwar zeigen manche dieser Verfahren wie z. B. die PPV eine hohe Sensitivität und Spezifität für eine fluid responsiveness [8], an der ausreichenden Validierung unter konstanter Überdruckbeatmung wird aber noch gezweifelt [2].
Für die Limitierung dieser Verfahren kann exemplarisch eine Darstellung von Pestel et al. (2009) bezüglich der beatmungsbedingten Schwankung der Pulsdruckkurve (dPP) übernommen werden: Bei einem dPP-Wert von über 13 % werden Patienten mit großer Wahrscheinlichkeit auf eine Volumengabe mit einer Verbesserung der Hämodynamik reagieren. Verschiedene Einflussfaktoren auf die dPP-Messung wurden bereits identifiziert, nämlich Beatmungsparameter, das Vorliegen eines Pneumoperitoneums und die Verwendung von Noradrenalin. Es bleibt abzuwarten, welche dieser Verfahren in dieser Fachgruppe positiv beurteilt werden, auch unter dem Gesichtspunkt des apparativen Aufwandes.
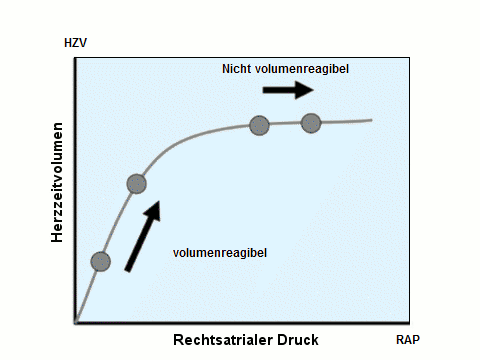
Ein wichtiges Argument wurde bereits erwähnt: Der Nachweis eines Volumen-Mangels von Plus nach Minus, also Ende der responsiveness bzw. reagibility auf der Frank-Starling-Kurve, birgt immer die Gefahr der Volumen-Überdosierung. Dieses Vorgehen wird mit der Abb. 3 demonstriert: Ein Volumen-Bolus wird so lange wiederholt appliziert, bis der obere, flache Teil der Frank-Starling-Kurve erreicht wird, der nicht mehr als „volumenreagibel“ eingestuft werden muss.
Zu Recht weist Jacob (München) auf dem DAC 2012 in Leipzig darauf hin: „Maximal ist nicht gleich optimal“.
Abb. 3: Darstellung des HZV als Funktion des rechtsatrialen Druckes anhand einer geringfügig modifizierten Abbildung (Abb. 3) von [Janssens et al. 2009].
Klinische Symptome eines Volumenmangels
Der Vollständigkeit halber muss an dieser Stelle erwähnt werden, welche klassischen Werte gefordert werden, eine „suffiziente Hämodynamik“ zu quantifizieren.
IVFV
Herzfrequenz ≤ 100 / min, MAP ≥ 80 mmHg, Urin-Ausscheidung ≥ 0,5 ml/kg/h, ZVD 5 - 10 mmHg.
Leider in Vergessenheit geraten: Der diastolische Blutdruck als Maß für den totalen peripheren Widerstand (TPR), der den Mitteldruck sowohl im Hochdrucksystem als auch im Niederdrucksystem erheblich beeinflusst.
ECFV inklusive IVFV
ZVD 5 - 10 mmHg, Osmolalität 290 ± 10 mosmol/kg H2O, Chlorid-Konzentration 103 ± 3 mmol/l, Körpergewichts-Kontrolle 0 ± 2 kg.
Literatur
- Adams HA, Baumann G, Cascorbi I et al.:
Interdisziplinäre Behandlungspfade: Hypovolämischer Schock. Eine Empfehlung der IAG Schock der DIVI.
Deutscher Ärzte-Verlag, Köln 2010. - Bendjelid K, Romand JA:
Fluid responsiveness in mechanically ventilated patients: A review of indices used in intensive care.
Intensive Care Med 2003; 29: 352-360 - Brunkhorst FM, Engel C, Bloos F et al.:
Intensive insulin therapy and pentastarch resuscitation in severe sepsis. N Engl J Med 2008; 358: 125-139 - Echt M, Düweling J, Gauer OH, Lange L:
Effective compliance of the total vascular bed and the intrathoracic compartment derived from changes in central venous pressure induced by volume changes in man.
Circ Res 1974; 34: 61-68 - Gelman S: Venous function and central venous pressure.
Anesthesiology 2008; 108: 735-748 - Janssens U, Graf J: Volumenstatus und zentraler Venendruck. Anaesthesist 2009; 58: 513-519
- Jacob M, Chappell D, Hofmann-Kiefer K et al.:
The intravascular volume effect of Ringer´s lactate is below 20 %: a prospective study in humans.
Crit Care 2012; 16: R86 - Kramer A, Zygun D, Hawes H et al.:
Pulse pressure variation predicts fluid responsiveness following coronary artery bypass surgery.
Chest 2004; 126: 1563-1568 - Kumar A, Anel R, Bunnell E et al.:
Pulmonary artery occlusion pressure and central venous pressure fail to predict ventricular filling volume, cardiac performance, or the response to volume infusion in normal subjects.
Crit Care Med 2004; 32: 691-699 - Marik PE:
Assessment of intravascular volume: A comedy of errors.
Crit Care Med 2001; 29: 1635-1636 - Michard F, Teboul JL:
Predicting fluid responsiveness in ICU patients: A critical analysis of the evidence.
Chest 2002; 121: 2000-2008 - Mythen MG, Webb AR:
Perioperative plasma volume expansion reduces the incidence of gut mucosal hypoperfusion during cardiac surgery.
Arch Surg 1995; 130: 423-429 - Pearse P, Dawson D, Fawcett J et al.:
Early goal-directed therapy after major surgery reduces complications trial [ISRCTN38797445].
Crit Care 2005; 9: R687-R693 - Perner A, Haase N, Guttormsen AB et al:
Hydroxyethyl starch 130/0.4 versus Ringer´s acetate in severe sepsis.
N Engl J Med 2012; 367: 124-134 - Pestel G, Fukui K:
Arterielle Pulskurve und Volumenstatus.
Anaesthesist 2009; 58: 415-420 - Riddez L, Hahn RG, Brismar B et al.:
Central and regional hemodynamics during acute hypovolemia and volume substitution in volunteers.
Crit Care Med 1997; 25: 635-640 - Shippy CR, Appel PL, Shoemaker WC: Reliability of clinical monitoring to assess blood volume in critically ill patients.
Crit Care Med 1984; 12: 107-112 - Venn R, Steele A, Richardson P et al.:
Randomized controlled trial to investigate influence of the fluid challenge on duration of hospital stay and perioperative morbidity in patients with hip fractures.
Br J Anaesth 2002; 88: 65-71 - Waisman Y, Eichacker PQ, Banks SM et al.:
Acute hemorrhage in dogs: Construction and validation of models to quantify blood loss.
J Appl Physiol 1993; 74: 510-519 - Weyland A, Grüne F:
Kardiale Vorlast und zentraler Venendruck.
Anaesthesist 2009; 58: 506-512 - Wilson RF, Chiscano AD, Quadros E et al.:
Some observations on 132 patients with septic shock.
J Int Anesth Res Soc 1967; 46: 751-763 - Zander R: Flüssigkeitstherapie, 2. erweiterte (korrigierte) Auflage, 2020
