
Individuelle Anämie-Diagnostik
Rolf Zander (Physioklin), Julika Schön und Matthias Heringlake (Klinik für Anästhesiologie und Intensivmedizin, Universitätsklinikum Schleswig-Holstein, Lübeck)
Fragestellung
Limitierende Organe einer Senkung der Hämoglobin-Konzentration (cHb) im Rahmen einer Anämie sind das Herz (Myokard) und das Gehirn (Zentralnervensystem, ZNS), weil sie in Ruhe eine besonders große O2-Utilisation aufweisen, also die prozentuale Entnahme von O2 während der Passage des Blutes durch das Organ, ausgedrückt als arterio-venöse O2-Differenz (avDO2). Beim Myokard sind dies ca. 50 % und beim ZNS im Mittel ca. 35 %.
Typisch für beide Organe ist die Tatsache, dass eine anämische Gewebehypoxie über eine erhebliche Durchblutungssteigerung um den Faktor 4 - 5 kompensiert wird, beim Myokard als Koronar-Reserve bezeichnet. Jede Durchblutungs-Steigerung führt zu einer Abnahme der avDO2 und kompensiert damit eine Abnahme der arteriellen, Anämie-bedingten O2-Konzentration.
Folgendes Beispiel soll dies verdeutlichen:
Wird die arterielle O2-Konzentration infolge Anämie von 20 auf 10 ml/dl halbiert und die avDO2 von 10 auf 2,5 ml/dl infolge Durchblutungs-Steigerung um den Faktor gesenkt, dann verbleiben auf der venösen Seite immer noch 7,5 statt ursprünglich 10 ml/dl.
Für die Diagnostik einer Anämie bieten sich daher beide Organe gleichermaßen als repräsentativ - weil limitierend - für den Gesamt-Organismus an. Da die entscheidende Kompensation einer Anämie über eine Durchblutungs-Steigerung erfolgt, die gerade beim alten Patienten eingeschränkt sein kann, darf eine Diagnostik an diesen beiden Organen als individuelle repräsentative Anämie-Diagnostik bezeichnet werden.
Mit der Nah-Infrarot-Spektroskopie (near infrared spectroscopy, NIRS) steht heute ein Verfahren zur Verfügung, dass eine nicht-invasive, kontinuierliche Messung der prozentualen, mittleren cerebralen Sauerstoff-Sättigung des Gehirns erlaubt (scO2, %).
Es soll geprüft werden, ob mit Hilfe von NIRS, also Messung der scO2, eine nicht-invasive, individuelle Anämie-Diagnostik möglich ist, wobei das ZNS als repräsentativ-limitierend interpretiert wird (index organ).
Vorbemerkungen zu NIRS (near infrared spectroscopy)
Ursprünglich als reines Neuro-Monitoring gedacht, wird Infrarotlicht mit einem Spektrum von 650 bis 1.100 nm durch die Schädelkalotte hindurch, also nicht-invasiv, in das Gehirn appliziert, um dieses dann mit Hilfe zweier Sensoren mit dem emittierten ursprünglichen Signal zu vergleichen. Derartige Sensoren werden üblicherweise beidseits auf das haarfreie Stirnhirn appliziert. Mit entsprechenden Algorithmen wird dann die sO2 des im regionalen Messfeld zufällig vorhandenen intravasalen Hämoglobins ermittelt. Neben anderen wird heute als Gerät das System INVOS (früher Somanetics, heute Covidien) eingesetzt. Da es mit nur zwei Wellenlängen arbeitet (730 und 810 nm) kann keine Differenzierung zwischen verschiedenen Hb-Derivaten (COHb, MetHb) vorgenommen werden. Daher müsste der Messwert eigentlich als partielle scO2 (pscO2) eingestuft werden [19]. Wegen der geringen klinischen Bedeutung dieser beiden Hb-Varianten wird hier die Bezeichnung scO2 für die „cerebrale“ sO2 verwendet ohne den häufig benutzten Zusatz „regional“ (rsO2).
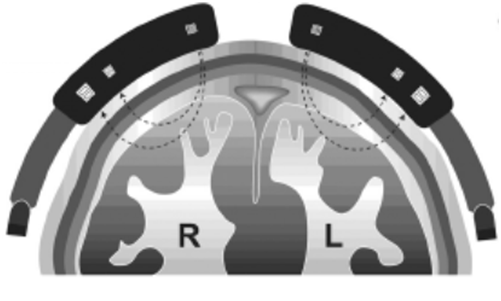
Aufgrund tierexperimenteller Studien darf angenommen werden, dass sich die Hämoglobin-Anteile zu 20 % auf arterielles, 5 % auf kapilläres und 75 % auf venöses Blut verteilen.
Damit wird der Messwert, neben der Zusammensetzung des arteriellen Blutes, vor allem von der des venösen Blutes bestimmt, das bedeutet aber, dass die avDO2 mit eingeht, die wiederum von der Durchblutung determiniert wird.
Unterstellt, dass der O2-Verbrauch des Gehirns mit seinem eigenen Einfluss auf die avDO2 gleich bleibt (Anästhesie, Hypothermie?), wird mit der scO2 ein Wert gemessen, der zum kleinen Teil arteriell und vornehmlich venös determiniert ist, also ein vorwiegend von der Hirndurchblutung (cerebral blood flow, CBF) bestimmter Wert.
Prüfung des INVOS-Systems auf Plausibilität
Wenn die Messung der scO2 zur nicht-invasiven, individuellen Anämie-Diagnostik über das ZNS als repräsentativ-limitierendes Organ erfolgen soll, dann kann der Einfluss-Faktor O2-Verbrauch ausgeschlossen werden, weil nur die Abnahme des O2-Verbrauchs infolge Hypothermie und Einfluss von Anästhetika zur Diskussion stehen. Abgesehen davon, dass diese Faktoren praktisch nur intraoperativ auftreten, können sie nur zu erhöhten Werten für die scO2 führen, was dem Patienten eher nützen ihn aber nicht gefährden kann.
Damit reduzieren sich die zu prüfenden Faktoren auf die
- Normalwerte der scO2 und ihre Altersabhängigkeit
- Änderung der O2-Konzentration des arteriellen Blutes (caO2, ml/dl)
- infolge Hypoxie (Abfall des paO2 und damit der saO2)
- infolge Hyperoxie (Erhöhung der FIO2)
- infolge Anämie (Abnahme der cHb mit kompensatorischer Zunahme des CBF) - Änderung der Durchblutung
- infolge Änderung des CO2-Partialdruckes (paCO2 bzw. petCO2)
- infolge Änderung des mittleren arteriellen Druckes (MAP).
Normalwerte der scO2
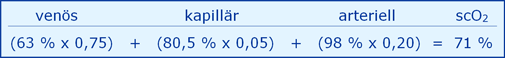
Aus den physiologischen Basisdaten wird der Normalwert der scO2 wie folgt entwickelt [24], nämlich ein mittleres (♂ / ♀) Gehirngewicht von 1.360 g, eine Durchblutung von 700 ml/min (15 % des HZV), eine mittlere (♂ / ♀) cHb von 14,6 g/dl, ein O2-Verbrauch von 50 ml/min und damit eine avDO2 von 7,1 ml/dl. Die daraus resultierende jugularvenöse svO2 ergibt daraus einen plausiblen Wert von 63 %.
Weiter wird unterstellt, dass sich die Volumenverteilung des Hämoglobins unter den Elektroden zu 20 % arteriell, 5 % kapillär und 75 % venös ergibt.
Unter Verwendung der folgenden Basis-Gleichung ergibt sich ein mittlerer cerebraler O2-Gehalt von 14,3 ml/dl:

Und daraus mit der Basis-Gleichung nach Umrechnung von Gehalt (ml/dl) in sO2 (%) eine mittlere scO2 von 71 %:
Mit dieser Basis-Gleichung kann dann später (s.u.) jede scO2 aufgrund einer Änderung der Durchblutung berechnet werden, wie folgendes Beispiel zeigen soll.
Bei einer Verdopplung der Durchblutung und damit Halbierung der avDO2 erhöht sich die scO2 auf 83 %:

Die folgende Tabelle zeigt Literaturwerte für Normal- bzw. Basiswerte der scO2 für den jugendlichen Erwachsenen mit einer cHb von 14 - 16 g/dl und einer saO2 von 97 - 98 %.
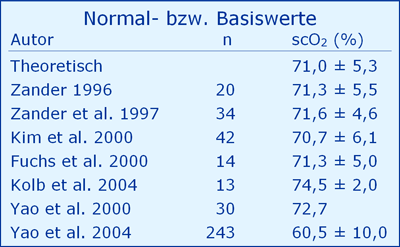
Fazit zum Normalwert
Abgesehen von einer Literaturstelle wird die theoretisch vorhergesagte scO2 des jugendlichen Erwachsenen mit ca. 71 % wiedergefunden.
Dies spricht sowohl für die Plausibilität der Berechnung aus physiologischen Basisdaten als auch für das Messverfahrens NIRS.
Altersabhängigkeit der scO2
Schon lange ist bekannt, dass der Messwert scO2 mit zunehmendem Alter abnimmt [24]. Aktuelle Daten [17] aus einem großen Kollektiv von Patienten perioperativ belegen dies.
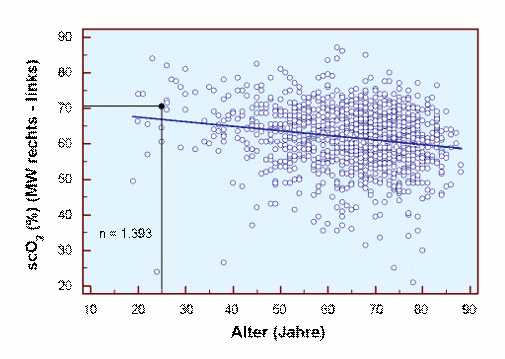
Die Ursache für diesen Befund könnte die Abnahme der Durchblutung und / oder die Abnahme der Hb-Konzentration sein, wie in den beiden folgenden Abbildungen getrennt für Männer und Frauen gezeigt.
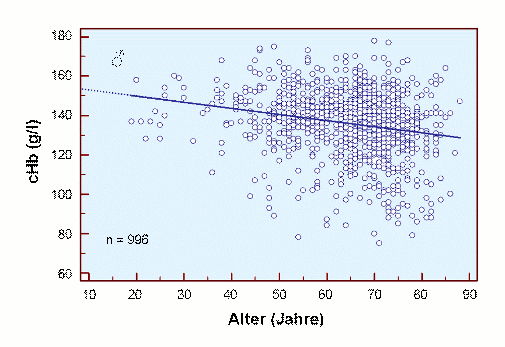
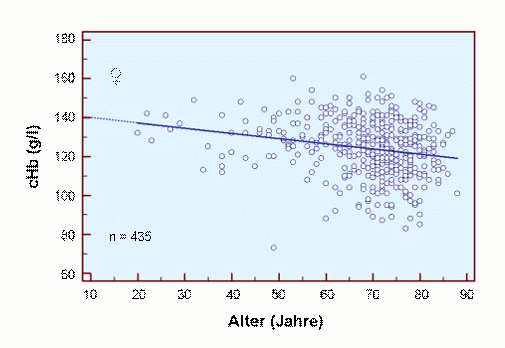
Es ist beruhigend, dass für den jugendlichen Erwachsenen unterschiedliche cHb-Werte für beide Kollektive gefunden werden, nämlich eine cHb von ca. 15 g/dl für Männer und eine cHb von ca. 14 g/dl für Frauen. Darüber hinaus ist deutlich zu erkennen, dass die cHb mit zunehmendem Alter abnimmt, eine teilweise Ursache für die Abnahme der scO2 mit zunehmendem Alter.
Damit kann für den Befund scO2 als Funktion des Alters eine vorsichtige Differenzierung zwischen der alleinigen Hb-bedingten Altersabhängigkeit (Alter und cHb) und der perioperativ gefundenen Altersabhängigkeit vorgenommen werden, bei der weitere Faktoren wie Blutdruck, Blutvolumen, pCO2 etc. einen Einfluss auf die scO2 ausüben können. Die entsprechenden Befunde sind in der Abbildung scO2 vs. Alter dargestellt.
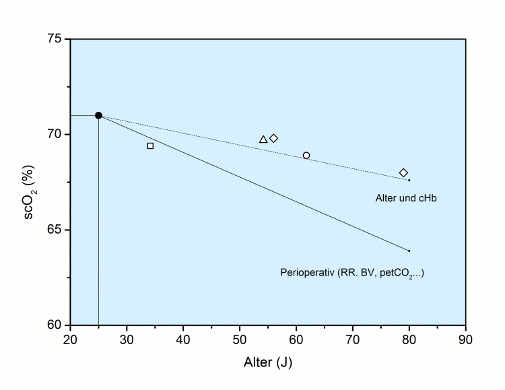
Abb.: scO2 vs. Alter: Der Zusammenhang zwischen scO2 und Alter perioperativ, aus der entsprechenden Abbildung oben als Funktion übernommen [17], ebenso der alleinige Zusammenhang Alter und cHb mit seiner Wirkung auf die scO2 [17, n = 1.414]. Zum Vergleich Literaturwerte, bei denen für Normalpersonen lediglich die altersabhängige scO2 ermittelt wurde [□ Litscher 1995; ∆ Colier 1995; ◊ Zander 1997; ○ Murkin 2007].
Fazit zur Altersabhängigkeit
Die Abnahme der scO2 mit zunehmendem Alter ist zu berücksichtigen, sie kann teilweise plausibel auf die gleichzeitige Abnahme der cHb zurückgeführt werden.
Arterielle Hypoxie (Abfall der saO2) und Hyperoxie (Anstieg der saO2)
Erwartungsgemäß muss die scO2 bei Abnahme der saO2 abnehmen, diese Abnahme fällt allerdings deutlich geringer aus als bei unveränderter Durchblutung zu erwarten wäre, weil die Durchblutungs-Steigerung diesen Befund zu kompensieren versucht. Jede arterielle Hypoxie stellt einen intensiven Reiz für eine Steigerung der Durchblutung dar, wie dies auch am Myokard zu beobachten ist.
Unter Hyperoxie kehren sich die Verhältnisse um: Zunahme der scO2 trotz Abnahme der Durchblutung. Die Verhältnisse sind in der folgenden Abbildung dargestellt.
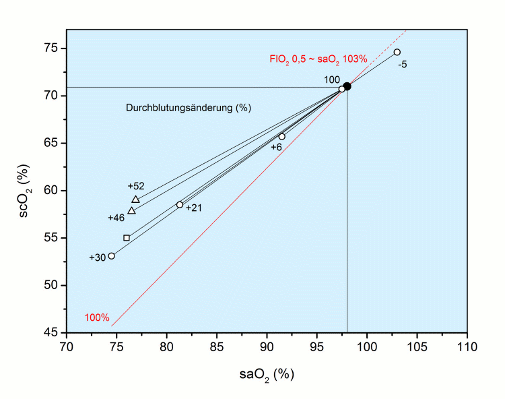
Abb.: Abhängigkeit der scO2 (%) von der arteriellen O2-Sättigung (saO2, %) unter Hypoxie: Erwartungsgemäß nimmt die scO2 weniger ab, als bei unveränderter Durchblutung (100 %, rot) zu erwarten wäre, weil die Durchblutung in verschiedenen Situationen mehr oder weniger deutlich gesteigert wird. Die Daten stammen aus Literaturangaben [∆ Zander 1996 (n = 20); ○ Kim 2000 (n = 42); □ Kolb 2004 (n = 13)]. Unter Hyperoxie mit einer fiktiven saO2 von 103 %, hingegen [○ Kim 2000] nimmt die scO2 zu, allerdings weniger als erwartet, weil die Durchblutung um 5 % abnimmt, ein Befund, der sich mit bis zu 10 % für alle Organe nachweisen lässt.
Fazit zur Hypoxie und Hyperoxie
Die Änderung der scO2 unter Hypoxie und Hyperoxie erfolgt plausibel, die Interpretation der erhobenen Messwerte schließt die zu erwartende Mehr- (Hypoxie) und Minder-Durchblutung (Hyperoxie) ein.
Durchblutungs-Änderung bei Hypo- und Hyperkapnie
Der arterielle CO2-Partialdruck (paCO2) übt, ausgehend vom Normalwert 40 mmHg, in beide Richtungen (Hypo- und Hyperkapnie) einen starken Einfluss auf die Hirndurchblutung aus. Änderungen des paCO2, unter klinischen Bedingungen meist als petCO2 (endtidal, endexspiratorisch) registriert, sollten daher zu entsprechenden Änderungen der scO2 führen.
Dies kann mit der Basis-Gleichung vorhergesagt werden (s.o.): Eine Durchblutungs-Änderung beeinflusst die avDO2, damit den venösen und somit auch den kapillären O2-Gehalt (Mittelwert arteriell - venös).
Nach Nunn [13] reagiert der CBF mit 1 - 2 ml/100 g min pro mmHg ∆pCO2 , das heißt bei einem CBF von 51,5 ml/100 g min (s.o.) wären dies zwischen 2 und 4 % pro mmHg. Für eine Hypokapnie von 30 mmHg wäre dies eine Abnahme der Durchblutung von 20 - 40 %. Dieser Bereich wurde in der folgenden Abbildung blau hinterlegt. Zum Vergleich wurde in der folgenden Abbildung für einen Autor [□ Yao 2000 (n = 30)] - mit rot markiert - die Änderung der Durchblutung für eine Hypokapnie von 30 mmHg mit - 30 % eingetragen, was offensichtlich optimal mit der Angabe von Nunn (20 - 40 %) übereinstimmt.
Weitere Literaturdaten wurden in die Abbildung aufgenommen, wobei zwischen Normoxie und Hypoxie unterschieden wurde.
Unter Normoxie ergibt sich als Vorhersage nach den Angaben von Lumb aus der Basis-Gleichung eine Steigung von ca. 1 % ∆scO2 / 1 mmHg (0,7 - 1,6 % / mmHg), die Literaturdaten liegen zwischen 0,7 % / mmHg [Normoxie ○ Kim 2000] und 1,7 % / mmHg [∆ Watzman 2000] bzw. dazwischen mit 1,1 % / mmHg [□ Yao 2000].
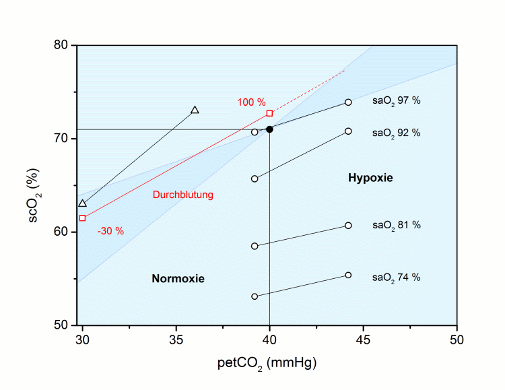
Abb.: scO2 (%) als Funktion des petCO2 (mmHg): Ausgehend von 40 mmHg petCO2 zeigt die scO2 eine vorhersagbare Änderung (blau hinterlegt). Verschiedene Literaturwerte sind eingetragen [Normoxie □ Yao 2000 (n = 30); ∆ Watzman 2000 (n = 6); Normoxie plus Hypoxie ○ Kim 2000 (n = 42)], die die Vorhersage bestätigen.
Unter Hypoxie scheint die Durchblutungs-Änderung gemäß Abbildung geringer auszufallen, es darf vermutet werden, dass der starke hypoxische Dilatationsreiz gegenüber dem hypo- oder hyperkapnischen Reiz dominiert
Ebenso unter Hyperoxie mit konsekutiver Vasokonstriktion sowie zusätzlicher Narkose wurde eine CO2-Abhängigkeit von nur 0,2 % scO2 Änderung pro mmHg petCO2-Änderung beschrieben [10].
Fazit zur Durchblutungs-Änderung infolge Hypo- und Hyperkapnie
Die Änderung der scO2 bei Änderung des petCO2, also Änderung der Durchblutung, erfolgt gemäß der Vorhersage, generiert aus physiologischen Basisdaten und mit diversen Literaturdaten belegt. Eine Hypokapnie auf z.B. 30 mmHg wird mit einer Durchblutungs-Abnahme um ca. 30 % bzw. der scO2 um ca. 10 % beantwortet (~ 1 % scO2 / 1 mmHg).
Durchblutungs-Abnahme bei Abnahme des MAP
Der Bereich der cerebralen Durchblutungs-Autoregulation wird allgemein für einen mittleren arteriellen Druck (MAP) von 50 bis 150 mmHg angegeben. Daher ist es nicht weiter verwunderlich, wenn an einem großen Kollektiv von Patienten perioperativ ein entsprechender Zusammenhang zwischen MAP und scO2 (%) in diesem Bereich nicht ersichtlich ist [17], wie in der folgenden Abbildung dargestellt.
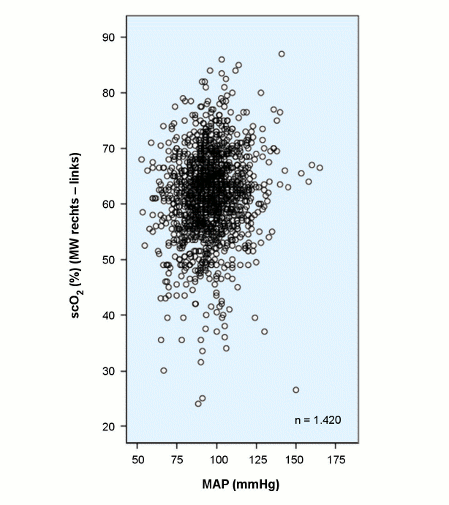
Abb.: scO2 (%) als Funktion des mittleren arteriellen Druckes (MAP, mmHg): Ein Zusammenhang zwischen scO2 und MAP ist kaum zu erkennen, insbesondere kein Abfall der scO2 bei Werten unter 80 mmHg, auch bedingt durch die große Streuung der Werte.
Über die Messung der Blutflussgeschwindigkeit mittlerer Cerebralgefäße (transkranialer Doppler, TCD) und der scO2 (NIRS) kann die untere Grenze der Autoregulation versuchsweise bestimmt werden. Weil dies für Patienten unter cardiopulmonalem Bypass entscheidend sein kann, wurden derartige Messungen vorgenommen: Das untere Limit wurde mit 63 (NIRS) bzw. 59 mmHg bestimmt [16], an einer großen Zahl von Patienten (n = 225) mit 66 mmHg (NIRS) [7].
Ebenso bedeutsam ist dies für Patienten, die bei der Schulter-Chirurgie in sitzender Position operiert werden (beach chair position), weil hier bei einem Abstand von ca. 30 cm zwischen Herzhöhe (Oberarm) und Gehirn (äußerer Gehörgang) der MAP und damit der cerebrale Perfusionsdruck (CPP) um ca. 22 mmHg (1 mmHg = 1,36 cmH2O) abnimmt. Damit gelangt ein Patient mit einem MAP von 80 mmHg sehr schnell an das untere Limit der cerebralen Autoregulation von ca. 65 mmHg, was sich bei Operationen in sitzender Position häufig mit NIRS nachweisen ließ, zusätzlich abhängig von der Art der gewählten Anästhesie [6]. Die Anästhesie allein führt zu einem Anstieg der scO2 von z.B. 68 - 69 auf 76 - 78 %, um dann beim Wechsel in die sitzende Position deutlich abzufallen [14, 6]. Der scO2-Abfall bei Wechsel zur sitzenden Position persistiert praktisch unverändert bei 66 - 67 %, auch wenn der MAP unter zusätzlicher induzierter Hypotension auf einen Wert von 60 - 65 mmHg gesenkt wird, gemessen auf Höhe des Gehirns [11]. Dies entspräche einem MAP von ca. 85 mmHg am Arm gemessen.
Entscheidend für diese Befunde dürfte die Anästhesie sein: Beim Wechsel in die sitzende Position wird keine signifikante Änderung der scO2 bei 14 wachen Freiwilligen mit einem Ausgangswert von 71,3 ± 5,0 % scO2 gefunden, bei Patienten unter Anästhesie hingegen nimmt die scO2 signifikant ab [4].
Fazit zur Abnahme des MAP
Eine Abnahme des MAP macht sich bei der Hirndurchblutung erst bei Werten unter ca. 65 mmHg bemerkbar, beim Patienten in sitzender Position wäre dies ein MAP (auf Herzniveau) von 85 mmHg.
Anämie (Abnahme der cHb mit kompensatorischer Zunahme des CBF)
Mit Hilfe der Basis-Gleichung (s.o.) können für eine Abnahme der cHb mehrere Vorhersagen getroffen werden.
Einmal kann berechnet werden, welche scO2-Änderungen sich als Funktion der cHb ergeben, wenn die Änderung des CBF maximal erfolgt (∆CBF max.). Die maximale Durchblutungs-Steigung beträgt 180 % bei cHb 7,3 g/dl und immerhin 440 % bei cHb 2,0 g/dl mit der Folge, dass bei dieser extremen Anämie die scO2 nur auf 56 % abfallen würde.
Ebenso kann ermittelt werden, wie sich die scO2 verändern wird, wenn überhaupt keine Durchblutungs-Zunahme erfolgen würde (∆CBF 0), bei einer cHb von 6 g/dl würde die scO2 nur noch 32 % betragen. Diese beiden Funktionen, ausgehend von 71 % scO2, sind in der folgenden Abbildung wiedergegeben.
Zwischen diesen beiden Extrem-Funktionen sind Literaturdaten eingetragen, bei denen die scO2 als Funktion der cHb gemessen wurde. In einem Falle wurde die cHb infolge einer Bluttransfusion angehoben und die Zunahme der scO2 verfolgt.
Zur Beurteilung der Frage, welche scO2-Werte als kritisch zu betrachten sind, wurde folgende Überlegung angestellt und eine Vorhersage mit der Basis-Gleichung vorgenommen:
Für den Extremfall, dass keine Durchblutungs-Zunahme unter Anämie (∆CBF 0) erfolgen könnte, wäre bei einer cHb von 6,8 g/dl ein jugularvenöser pO2 von 20 mmHg erreicht (pvO2 20 mmHg), der einer scO2 von 42 % entsprechen würde. Dieser jugularvenöse pO2 von 20 mmHg gilt allgemein als Grenzwert, unterhalb dessen ein Patient das volle Bewusstsein verliert [13]. Dabei stellt das ZNS seine Funktion teilweise ein ohne einen strukturellen Schaden zu erleiden. Somit kann als vorsichtiger Grenzwert eine scO2 von ca. 40 % angenommen werden, der aus Sicherheitsgründen auf eine scO2 von 50 % angehoben werden könnte: Therapeutischer Grenzwert der scO2 = 50 %.
Alle diese Überlegungen sind in der folgenden Abbildung zusammengefasst.
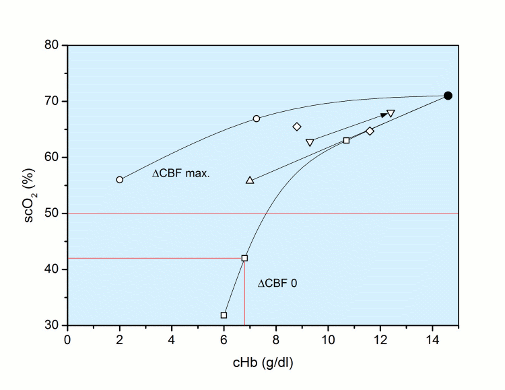
Abb.: scO2 (%) als Funktion der cHb (g/dl) für die beiden Grenzfälle maximale (∆CBF max) und keine Durchblutungs-Steigerung (∆ CBF 0); dazwischen liegen Literaturdaten [∆ Schön et al. 2013 (n = 1.390); ◊ Zander 1996; ▼ Bailey 2010]. Für den Fall keine Durchblutungs-Steigerung (∆CBF 0) wird bei einer cHb von 6,8 g/dl ein scO2-Grenzwert von 42 % erreicht, bei dem das ZNS das volle Bewusstsein verlieren würde. Ein klinischer Grenzwert der scO2 ist bei 50 % eingetragen.
Unter klinischen, perioperativen Bedingungen wurden entsprechende Befunde erhoben [17], und zwar unter Normoxie und Hyperoxie (FIO2 1,0), wie in den beiden folgenden Abbildungen dargestellt.
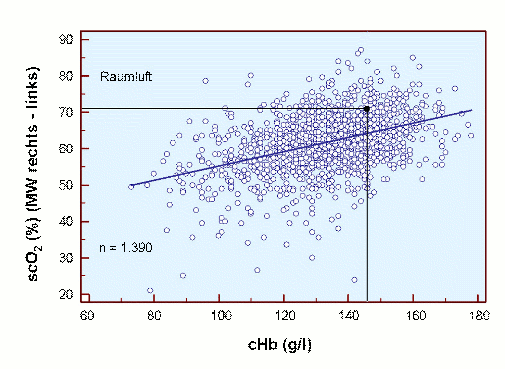
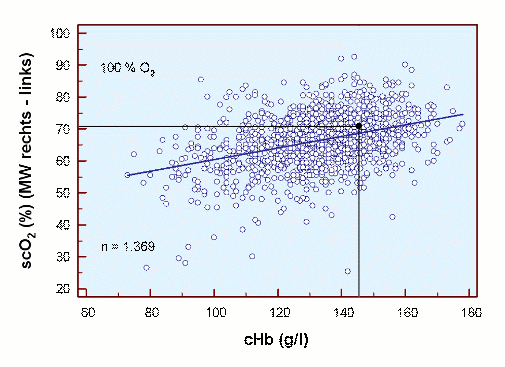
Es ist deutlich zu erkennen, dass trotz großer Streuung der Normalwert von 71 % scO2 bei cHb 14,6 g/dl unter Raumluft fast und dann unter Hyperoxie gut erreicht wird. Die mittlere scO2 nimmt in beiden Fällen unter Anämie ab und erreicht bei ca. 7 g/dl den Wert von 50 % scO2 (Raumluft) bzw. 55 % scO2 (Hyperoxie). Eine Hyperoxie erhöht die scO2 bei allen Werten der cHb um ca. 5 %.
Fazit zur Änderung der cHb
Die Änderung der scO2 bei Abnahme der cHb erfolgt plausibel, die Interpretation der erhobenen Messwerte schließt die zu erwartende Mehr-Durchblutung ein. Bei einer cHb von 6,8 g/dl wird ein scO2-Grenzwert von 42 % erreicht, der für den Fall einer ausbleibenden Durchblutungs-Steigerung den Verlust des vollen Bewusstseins bedeuten würde.
Generelles Fazit zur scO2 gemessen mit NIRS
Unter Verwendung physiologischer Basisdaten des O2-Gehalts von arteriellem und venösem Blut sowie der Durchblutung und der daraus resultierenden avDO2 können mit der so genannten Basis-Gleichung zu erwartende Änderungen der mittleren cerebralen scO2 (%) berechnet und mit Literaturdaten verglichen werden. Daraus ergeben sich folgende Aussagen:
- Die berechnete scO2 des jugendlichen Erwachsenen wird mit 71 % wiedergefunden.
- Die Abnahme der scO2 mit dem Alter kann teilweise auf die gleichzeitige Abnahme der cHb zurückgeführt werden.
- Die Änderung der scO2 unter arterieller Hypoxie und Hyperoxie schließt die zu erwartende Mehr- (Hypoxie) und Minder-Durchblutung (Hyperoxie) ein.
- Eine Änderung der Durchblutung infolge Hypo- oder Hyperkapnie wird mit etwa 1 % scO2-Änderung pro 1 mmHg petCO2-Änderung beantwortet.
- Eine Abnahme des MAP macht sich erst beim Wert unter ca. 65 mmHg bemerkbar, beim Patienten in sitzender Position wäre dies ein MAP (Herzniveau) von 85 mmHg.
- Eine Anämie im Sinne einer Abnahme der cHb führt zu einer Mehr-Durchblutung; für den Extremfall einer fehlenden Durchblutungs-Steigerung wird bei einer cHb von 6,8 g/dl ein scO2-Grenzwert von 42 % erreicht, den Verlust des vollen Bewusstseins limitierend.
Objektivierung einer individuellen Anämie-Diagnostik mit Hilfe der mittleren cerebralen sO2 (scO2, NIRS)
Ausgehend von der Überlegungen, dass NIRS beim Menschen als Modell für die Gewebe-Oxygenierung bei unkompensierter Blutung fungieren könnte [18], also NIRS als „Transfusions-Trigger“ [19], wurde mit NIRS schon 2007 ein intraoperativer Algorithmus zur Optimierung der O2-Versorgung des ZNS entwickelt [3].
Dieser Gedanke wird hier aufgegriffen: Mit der Messung der scO2 über NIRS soll eine nicht-invasive, individuelle Anämie-Diagnostik ermöglicht werden, wobei das ZNS quasi als „index organ“ repräsentativ-limitierend interpretiert wird.
Das klinische perioparative Procedere könnte wie folgt aussehen: Die scO2 beträgt < 50 %, dann werden folgende Kontrollen in der angegebenen Reihenfolge geprüft und eventuell korrigiert, bis die scO2 ˃ 50 % ansteigt:
- Hypoxie: Überprüfung der arteriellen sO2 mit dem Pulsoxymeter (Ziel ˃ 95 %),
- Hypokapnie: Kontrolle des petCO2 bzw. der Spontan-Atmung (Ziel 40 ± 5 mmHg),
- Hypotonie: Überprüfung des MAP (Ziel ˃ 80 mmHg),
- Hypovolämie: MAP persistiert < 80 mmHg (Ziel ˃ 80 mmHg),
- Anämie: Die scO2 persistiert < 50 %,
FIO2 1,0 einstellen (funktionelle Transfusion ∆cHb = 1,5 g/dl = 2 EKs), steigt die scO2 ˃ 50 % ist die Gabe von EKs indiziert.
Cave: Die infolge Hyperoxie zu erwartende Durchblutungs-Abnahme könnte die Erhöhung des caO2 und damit der scO2 gerade ausgeglichen haben.
Literatur
- Bailey SM, Hendricks-Munoz KD, Wells JT, Mally P:
Packed red blood cell transfusion increases regional cerebral and splanchnic tissue oxygen saturation in anemic symptomatic preterm infants.
Am J Perinatol. 2010; 27: 445 - 453 - Colier WNJM, van Haaren NJWC, Oeseburg B:
A comparative study of two near infrared spectrophotometers for the assessment of cerebral haemodynamics.
Acta Anaesthesiol Scand 1995; 39 (Suppl. 107): 101 - 105 - Denault A, Deschamps A, Murkin JM:
A proposed algorithm for the intraoperative use of cerebral near-infrared spectroscopy.
Semin Cardiothorac Vasc Anesth 2007; 11: 274 - 281 - Fuchs G, Schwarz G, Kulier A, Litscher G:
The influence of positioning on spectroscopic measurements of brain oxygenation.
J Neurosurg Anesthesiol 2000; 12: 75 - 80 - Heringlake M, Garbers C, Käbler J-H, Anderson I, Heinze H, Schön J, Berger K-U, Dibbelt L, Sievers HH, Hanke T:
Preoperative cerebral oxygen saturation and clinical outcomes in cardiac surgery.
Anesthesiology 2011; 114: 58 - 69 - Jeong H, Lee H, Jang EA et al.:
Haemodynamics and cerebral oxygenation duri9ng arthroscopic shoulder surgery in beach chair position under general anaesthesia.
Acta Anaesthesiol Scand 2012; 56: 872 - 879 - Joshi B, Ono M, Brown C et al.:
Predicting the limits of cerebral autoregulation during cardiopulmonary bypass.
Anesth Analg 2012; 114: 503 - 510 - Kim MB, Ward DS, Cartwright DR et al:
Estimation of jugular venous O2 saturation from cerebral oximetry or arterial O2 satuation during isocapnic hypoxia.
J Clin Monit 2000; 16: 191 - 199 - Kolb JC, Ainslie PN, Ide K, Poulin MJ:
Protocol to measure acute cerebrovascular and ventilatory responses to isocapnic hypoxia in humans.
Respir Physiol Neurobiol 2004; 141: 191 - 199 - Kraus B, Renz D, Karliczek GF:
Near infrared spectroscopy for testing cerebral CO2 reactivity (Poster).
Congress of the European Association of Cardiothoracic Anaesthesiologists, Thessaloniki (Greece) 1997 - Lee JH, Min KT, Chun Y-M et al.:
Effects of beach-chair position and induced hypotension on cerebral oxygen saturation in patients undergoing arthroscopic shoulder surgery.
Arthroscopy 2011; 27: 889 - 894 - Litscher G, Schwarz G, Jobstmann R et al.:
Nichtinvasive Überwachung der regionalen zerebralen auerstoffsättigung – Erfahrungen aus der Intensivmedizin.
Biomed Technik 1995; 40: 70 - 75 - Lumb A: Nunn’s Applied Respiratory Physiology (4th ed.)
Butterworth-Heinemann, Oxford 2000 - Moerman AT, de Hert SG, Jacobs TF et al.:
Cerebral oxygen desaturation during beach chair position.
Eur J Anaesthesiol 2012; 29: 82 - 87 - Murkin JM, Adams SJ, Novick RJ et al.:
Monitoring brain oxygen saturation during coronary bypass surgery: A randomized, prospective study.
Anesth Analg 2007; 104: 51 - 58 - Ono M, Joshi B, Brady K et al.:
Risks for impaired cerebral autoregulation during cardiopulmonary bypass and postoperative stroke.
Br J Anaesth. 2012; 109: 391 - 398 - Schön J, Heringlake M:
Persönliche Mitteilung – Auswertung von Observationsdaten aus den Jahren 2008 und 2009, die u.a. Grundlage für die Publikation [5] waren. - Torella F, Cowley RD, Thorniley MS, McCollum CN:
Regional tissue oxygenation during hemorrhage: Can near infrared spectroscopy be used to monitor blood loss?
Shock 2002; 18: 440 - 444 - Torella F, Haynes SL, McCollum CN:
Cerebral and peripheral near-infrared spectroscopy: an alternative transfusion trigger?
Vox Sanguinis 2002; 83: 254 - 257 - Watzman HM, Kurth CD, Montenegro LM et al.:
Arterial and venous contributions to near-infrared cerebral oximetry.
Anesthesiology 2000; 93: 947 - 953 - Yao F-SF, Tseng C-C, Yu J, Herman N:
Relationship between etCO2 and cerebral oxygen saturation.
Anesthesiology 2000; 93: A320 - Yao F-SF, Yao D, Jin J:
Age and gender differences in cerebral oxygen saturations.
Anesthesiology 2004; 101: A193 - Zander R:
Die nicht-invasive Messung der mittleren zerebralen O2-Sättigung des Hämoglobins.
Anästhesiol Intensivmed Notfallmed Schmerzther 1996; 31: 378 - 380 - Zander R, Rehfisch P:
Nichtinvasive Messung der zerebralen Hämoglobin-Sauerstoff-Sättigung.
Anästhesiol Intensivmed Notfallmed Schmerzther 1997; 32 (Suppl. 2): 220 - 223
_______________
Interessenkonflikt: Alle drei Autoren haben Vortragshonorare von Covidien (Neustadt) erhalten.
