
Entschlackung
Was verbirgt sich hinter dem Begriff „Entschlackung“?
Ein Beitrag für medizinische Laien, Heilpraktiker, Ökotrophologen, Pharmazeuten und Mediziner.
Am 10.04.2019 wurden Korrekturen in zwei Tabellen vorgenommen.
Zusammenfassung
Hier werden verschiedene Thesen zum Thema Entschlackung aus drei Büchern aus dem Verlag P. Jentschura (Münster) [1 - 3] mit wissenschaftlichen Argumenten widerlegt.
Die 10 Thesen werden im Folgenden als „J-Thesen“ bezeichnet.
Die wichtigsten Ergebnisse lauten:
- Es gibt keinen Hinweis, was Schlacken sind, eine Entschlackung ist daher überflüssig.
- Praktisch alle Nahrungsmittel sind Basenbildner, Säurebildner sind extrem selten.
- Eine ernährungsbedingte Azidose ist auszuschließen.
- Eine Säure-Ausscheidung über die Haut findet nicht statt, der pH der Haut mit ca. 5,5 hat eine andere Bedeutung.
- Alle im Organismus entstehenden Säuren, nämlich Salzsäure, Kohlensäure, Milchsäure oder Schwefelsäure werden perfekt neutralisiert oder problemlos ausgeschieden.
- Eine therapeutische Entsäuerung des gesunden Organismus ist vollkommen überflüssig.
- Die Behauptung, das Baby (der Fet) scheide 9 Monate lang Säuren und Gifte ausschließlich über die Haut an das basische Fruchtwasser der Mutter aus, ist vollkommen abwegig.
In einem Anhang werden die verschiedenen, im Organismus erscheinenden Säuren und ihre Behandlung im Stoffwechsel besprochen. Der Säure- und Basen-Gehalt von Nahrungsmitteln wird geklärt.
Dieser Beitrag ist zugleich eine Fortsetzung eines früheren Beitrages vom August 2012 zum Thema Gibt es eine ernährungsbedingte Azidose?
1. J-These: Schlacken
Schlacken sind nicht ausgeschiedene, durch Mineralstoffe neutralisierte, an Fett und Wasser gebundene und dann abgelagerte Säuren und Gifte. Zahlreiche Vital-, insbesondere Mineralstoffe entfalten… basische Wirkung… neutralisieren aggressive Säuren…verbinden sich zu pH-neutralen Salzen… wenn sich diese ablagern nennt man sie Schlacken. 50 % des Körpers vieler Menschen bestehen aus Schlacken.
Antithese
Hier sollte eine konkrete Definition von Schlacken wiedergegeben werden, am besten mit Literaturangabe, also einige Beispiele von Säuren und Mineralstoffen bzw. Giften und Mineralstoffen, die Schlacken bilden. Auch wäre es interessant gewesen, Beispiele von Menschen zu beschreiben, deren Körper zu 50 % aus Schlacken bestehen. Der Versuch, „Experten“, willkürlich ausgewählt aus dem Internet, zu einer Definition von Schlacken zu bewegen, schlug leider fehl. Von einer Ausnahme abgesehen wollte oder konnte keiner der Angeschriebenen, die sich im Internet zum Thema präsentieren, eine Definition liefern [4]. Ausnahme: "Verschlackung: umgangssprachliche Bez. für die Ablagerung von eliminationspflichtigen Zwischen- u. Endprodukten des Stoffwechsels (z.B. Harnsäure), Exo- u. Endotoxinen, Immunkomplexen u.a. in Bindegewebe od. Interstitium sowie in bradytrophe Gewebe „ [Pschyrembel "Wörterbuch Naturheilkunde und alternative Heilverfahren", Walter de Gruyter, Berlin, 1996].
2. J-These: Säuren
Woher kommen die Säuren? Salzsäure aus Kochsalz, Kohlensäure aus Getränken, Schwefelsäure z. B. aus Eiern.
Antithese: Salzsäure (HCl)
Die Bildung von Salzsäure (HCl) aus Kochsalz (NaCl) ist chemisch nur schwer möglich, es sei denn man fügt - im Labor - konzentrierte Schwefelsäure zu NaCl dazu (NaCl + H2SO4 = HCl + NaHSO4). Die Bildung von Salzsäure im Magen hingegen erfolgt energieintensiv in den Belegzellen, wobei einerseits Chlorid-Ionen (Cl-) und andererseits Protonen (H+) sezerniert werden, die aus der Reaktion von CO2 + H2O = H2CO3 (= HCO3- + H+) stammen (s. Anhang).
Antithese: Kohlensäure
Wenn im allgemeinen Sprachgebrauch von Kohlensäure (H2CO3) gesprochen wird, ist üblicherweise das Gas Kohlendioxid (CO2) gemeint, das in Verbindung mit Wasser (H2O) zur Kohlensäure (H2CO3) hydratisieren kann (CO2 + H2O = H2CO3). Diese Reaktion ist reversibel, d.h. aus der Kohlensäure kann durch Dehydratisierung auch wieder CO2 entstehen. Kohlensäure schmeckt leicht säuerlich im Mund.
Im gepufferten Blut-Plasma liegt beim normalen pCO2 von 40 mmHg und einem pH von 7,40 nur eine sehr kleine Konzentration von 1,2 mmol/l CO2 bzw. H2CO3 vor (37 °C). Im nicht gepufferten Wasser hingegen beträgt der pH beim pCO2 von 40 mmHg und gleicher H2CO3-Konzentration schon nur noch 5,1 [eigener Messwert, Zander 1995].
Allein durch Schütteln einer Flüssigkeit an der Luft kann man zum Beispiel das Kohledioxid (CO2) entfernen: Schütteln von „Kohlensäure-haltigem“ Wasser, Cola oder Sekt, lässt den pH-Wert deutlich in Richtung 7,0 steigen.
Die Konzentration der Kohlensäure beträgt in allen Flüssigkeitsräumen des Organismus (extra- und intrazellulär) ca. 1 mmol/l, ohne dass dies zu Problemen führen würde.
Ganz im Gegenteil: Die Kohlensäure liefert in allen Stoffwechselorganen (vor allem der Leber und des Magens, s.o.) wichtige Wasserstoff-Ionen (H+-Ionen) für eine Vielzahl von Stoffwechselprozessen (s. Anhang).
Antithese: Schwefelsäure aus Eiern
Bei den Eiweißbausteinen, den Aminosäuren, gibt es säuernde (Lysin, Arginin, Methionin, Cystein) und alkalisierende (Asparaginsäure, Glutaminsäure) wie unten im Anhang beschrieben (Zander 1995).
Richtig ist, dass beim Abbau von Methionin und Cystein das Endprodukt SO3 und nach Hydratisierung die Schwefelsäure (H2SO4) entsteht, die anstandslos täglich als 2 H+ und SO42- über die Niere eliminiert wird. Richtig ist aber auch für das Hühnerei, dass eine Berechnung der potentiellen Wirkung auf den Säure-Basen-Haushalt unter Berücksichtigung aller Aminosäuren das erstaunliche Ergebnis liefert, dass die Summe der alkalisierenden Aminosäuren praktisch identisch ist mit der Summe der säuernden Aminosäuren (s. Anhang). Das bedeutet, dass der Verzehr auch großer Mengen von Hühnerei keinen Einfluss auf den Säure-Basen-Haushalt ausüben kann.
Dies wurde schon in einem entsprechenden Selbstversuch (2 Probanden, je 15 Eier zum Frühstück) demonstriert, hier nachzulesen Gibt es eine ernährungsbedingte Azidose?
Die Bilanz von Säuren zu Basen dieses Selbstversuchs, 15 Eier zum Frühstück (pH-Wert 7,6 bis 7,9), lautet: 15 Eier á ca. 60 g machen 900 g aus, die Summe der Säuren beträgt damit 200 mmol, die der Basen 210 mmol, also praktisch ausgeglichen (s. Anhang). Leider wurde die Sulfat-Ausscheidung damals nicht gemessen: Die Methionin-Konzentration beträgt 3 mmol/100g und die von Cystein 2,6 mmol/100g, damit wären jedem Probanden mit den 900 g Hühnerei zusammen 50 mmol dieser beiden Aminosäuren zugeführt worden, die nach vollständigem Abbau den gleichen Betrag an Sulfat hätten liefern müssen. Gemessen an der täglichen Ausscheidung von 25 mmol ein beträchtlicher Wert.
3. J-These: Blut im basischen Bereich
Unser Blut muss unter allen Umständen im basischen Bereich zwischen pH 7,35 und pH 7,45 bleiben...
Antithese
An Kollektiven eigener Datensätze soll gezeigt werden, dass diese Aussage nicht haltbar ist
- Sportler entwickeln unter Belastung eine reversible Milchsäure-Azidose bis zu einem BE von -20 mmol/l, das entspricht bei einem pCO2 von 40 mmHg einem pH von 7,05 ohne dass jedwede Probleme auftreten.
Die folgende Abbildung entstammt der Arbeit von Lachtermann und Zander [Anästhesiologie & Intensivmedizin 1999; 40: S204]. Sie zeigt eindeutig, dass der Sportler Milchsäure bildet und auch verstoffwechselt: direkte Proportionalität (mmol/l) zwischen dem Base Excess (mmol/l im Blut) als Maß für die entstandenen H+-Ionen der Milchsäure einerseits und der Laktat-Konzentration (mmol/l im Plasma) als direkter Nachweis des Milchsäure-Anions andererseits. Die Werte wurden unter Belastung und anschließender Erholung gewonnen und als Differenz zum Ausgangswert dargestellt.
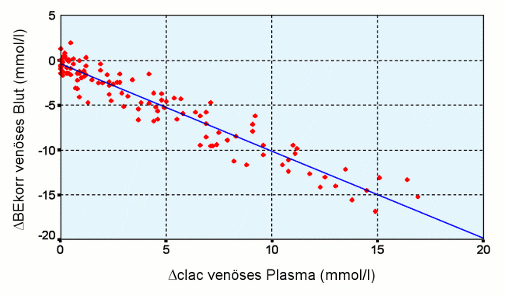
- Patienten unter therapeutischer Hyperventilation entwickeln einen pCO2 von 13 mmHg und damit einen pH von 7,73 ohne jegliche Probleme. Nach Beendigung dieser Maßnahme normalisiert sich der pH in wenigen Minuten [unveröffentlichte Daten].
4. J-These: Kapazitäten Puffersysteme
Verschiedene Puffersysteme mit begrenzten Kapazitäten... Sind die verfügbaren Pufferkapazitäten des Blutes erschöpft, beginnt der pH-Wert des Blutes zu sinken...
Antithese
Die Puffersysteme bzw. Pufferkapazitäten des Blutes können praktisch nicht erschöpfen. Sie bestehen im Wesentlichen aus dem Hämoglobin und dem Bikarbonat (HCO3). Zusammen verfügen sie beim pH von 7,4 über eine Pufferkapazität von 63 mmol/l/pH, das heißt, wenn zu 1 Liter Blut 63 mmol Säure zugesetzt würden, würde der pH um eine Einheit abnehmen. Benennt man diese normale Pufferkapazität mit 100 %, dann reduziert sich diese bis zu einem extremen pH von 6,52 (BE -40 mmol/l) auf immerhin noch verbleibende 55 %. Selbst bei dieser Extrembetrachtung kann nicht von einer „Erschöpfung“ gesprochen werden.
Um die immense Pufferkapazität des Blutes zu demonstrieren, sei auf folgendes hingewiesen: Wird das Blut mit 10 mmol/l Säure belastet (BE -10 mmol/l), sinkt der pH von 7,40 auf 7,244. Würde die gleiche Säuremenge reinem Wasser zugesetzt, würde der pH von 7,0 auf 2,0 fallen (10 mmol/l = 0,01 mol/l = pH von 2,0).
5. J-These: Pufferkapazitäten Blut
Sind die verfügbaren Pufferkapazitäten des Blutes erschöpft, beginnt der pH-Wert des Blutes zu sinken... Die Puffersysteme des Blutes sind mit der Neutralisierung und dem Abtransport von Säuren und Schadstoffen überlastet... So kommt es zu einer dauerhaften Säurebelastung der Gewebe.
Antithese
Neben der Pufferkapazität des Blutes mit 63 mmol/l/pH gibt es ein weiteres, viel wichtigeres Puffersystem, nämlich den gesamten Extrazellularraum, also den Raum um alle Zellen herum. Dieser Raum umfasst 15 Liter (bei 75 kg Körpergewicht) und enthält die wichtige Pufferbase Bikarbonat (HCO3) mit einer Konzentration wie im Plasma, also auch 24 mmol/l.
Die Pufferkapazität dieser Flüssigkeit beträgt mit 55 mmol/l/pH etwas weniger, da das Volumen aber dreimal größer ist, ist die Pufferkapazität des Extrazellularraums mehr als doppelt so groß wie die des Blutes.
Folgende Bilanz soll die immense Pufferkapazität des Extrazellularraums verdeutlichen:
Ein Sportler entwickelt einen Base Excess von -20 mmol/l mit einem pH von 7,05 (s.o.), das bedeutet, dass in seinen 15 l Extrazellularraum 20 mmol/l Milchsäure angefallen sind, also hat er in seiner Muskulatur 300 mmol Milchsäure gebildet (20 x 15). Gemessen an der täglichen Säure-Ausscheidung von 50 mmol (s.u.) ein immenser Betrag. Seine Leber hingegen benötigt für den Abbau dieser Milchsäure nur ca. 1 Stunde.
6. J-These: Babies im Fruchtwasser
Babies wachsen im basischen Fruchtwasser der Mutter heran und scheiden neun Monate lang Säuren und Gifte fast ausschließlich über die Haut aus.
Antithese
Die Fruchtwassermenge nimmt vom 3. Schwangerschaftsmonat mit 30 ml bis zur Geburt mit 800 - 1.000 ml zu. Ab dem 5. Schwangerschaftsmonat trinkt der Fetus ca. 400 ml Fruchtwasser täglich. Über den kindlichen Darm wird die aufgenommene Flüssigkeit resorbiert und gelangt über die Plazenta in den mütterlichen Blutkreislauf. Nachdem auch die Nieren des Embryos ihre Funktion aufgenommen haben wird das geschluckte Fruchtwasser auch über die Harnwege als wenig konzentrierter Urin wieder ausgeschieden. So wird am Ende der Schwangerschaft das Fruchtwasser etwa alle 3 Stunden durch diese Austauschmechanismen erneuert.
Die Zusammensetzung des Fruchtwassers ähnelt sehr der Extrazellulär-Flüssigkeit bezüglich seiner Natrium-, Kalium-, Chlorid-, Magnesium- und Calcium-Konzentration. Die Proteinkonzentration beträgt nur etwa 1/10 bis 1/20 der Werte des Plasmas, d.h. nennenswerte Puffersysteme sind nicht vorhanden, weil die Mutter die Entsorgung übernimmt. Der pH ist mit 7,2 vergleichbar dem mütterlichen Wert.
Eine Ausscheidungsfunktion von Säuren über die Haut ist nicht erforderlich und daher in der wissenschaftlichen Literatur nicht beschrieben.
7. J-These: Übersäuerung der Erythrozyten
Bei zunehmender Übersäuerung des Blutes werden die Erythrozyten immer steifer und verklumpen zunehmend bis zur sog. „Geldrollenbildung“. Das Blut wird dickflüssig,... träger,... beginnt der pH-Wert des Blutes zu sinken... und die Viskosität des Blutes nimmt ab.
Antithese
Richtig ist, dass die reversible Aggregation der Erythrozyten, die sog. „Geldrollenbildung“ (Rouleaux-Bildung) unter Normalbedingungen bei langsamer Strömungsgeschwindigkeit des Blutes zu beobachten ist. Sie wird für die physiologische Viskositätszunahme bei langsamer Strömung verantwortlich gemacht. Die erste Aussage, Verklumpen der Erythrozyten bei zunehmender Übersäuerung, ist sicher unzutreffend, es sei denn der pH-Wert würde in extreme Bereiche weit unter 7,0 gesenkt.
Bei der zweiten Aussage, „Viskosität des Blutes nimmt ab“ bei Azidose, dürfte es sich um einen Druckfehler handeln (soll heißen „nimmt zu“).
8. J-These: Schweißdrüsen und Säuren
Über Hunderttausende von Schweißdrüsen werden in erster Linie Säuren ausgeschieden.
Antithese
Pro Tag werden 0,3 - 0,5 l Schweiß abgegeben, unter Hitze-Belastung auch 2 - 3 Liter. Im Vergleich zum Plasma enthält er mit 30 - 50 mmol/l Natrium und dementsprechend Chlorid nur wenig NaCl. Der stark schwankende Harnstoffgehhalt ist etwa doppelt so hoch wie der Plasmawert, der Gehalt an Glukose beträgt nur etwa 10 % des Plasmawertes. Die Milchsäure-Konzentration des Erwachsenen-Schweißes beträgt 4 - 40 mmol/l, also das 2,5 - 25-fache des normalen Plasmawertes. Sie nimmt bei Zunahme der Schweißsekretion deutlich ab.
Unter Extrembedingungen, also 3 Liter Schweiß pro Tag mit ca. 20 mmol/l Milchsäure, würden somit pro Tag 60 mmol Milchsäure mit dem Schweiß abgegeben, also praktisch identisch mit der stündlichen Milchsäureproduktion in körperlicher Ruhe, also höchstens ca. 5 % der Milchsäureproduktion des Körpers in Ruhe (s.u.).
Entscheidend aber ist die Feststellung, dass diese Milchsäure nicht aus dem Organismus stammt, sondern Endprodukt des anaeroben Stoffwechsels der ca. 2 Mio. Schweißdrüsen ist. Also findet über den Schweiß keine Ausscheidung von Säuren statt, belegt am Beispiel der Milchsäure.
9. J-These: Basenüberschüssige Ernährung
Präventive, basenüberschüssige Ernährung... zusätzliche Säurebelastung... durch feine Schokolade... zahlreiche Vital-, insbesondere Mineralstoffe entfalten... basische Wirkung, Empfehlung 80 % basenüberschüssige und neutrale Lebensmittel, 20 % säureüberschüssige Lebensmittel.
Antithese
In verschiedenen Büchern werden immer wieder Beispiele für basenüberschüssige und für säureüberschüssige Lebensmittel angeboten. In der folgenden Tabelle werden diese mit B für Basenbildner (grün) und S für Säurebildner (rot) gekennzeichnet, die Zahlen in Klammern geben den (gerundeten) Betrag an in mmol H+ pro 100 g, von einigen Autoren als PRAL = potential renal acid load in mmol / 100 g bezeichnet. Zusätzlich zu den angeführten Autoren sind Daten aufgenommen (Physioklin). Diese sind in einer gesondert entwickelten Tabelle des Anhangs aufgeführt, neutrale Lebensmittel wurden mit 0 gekennzeichnet.
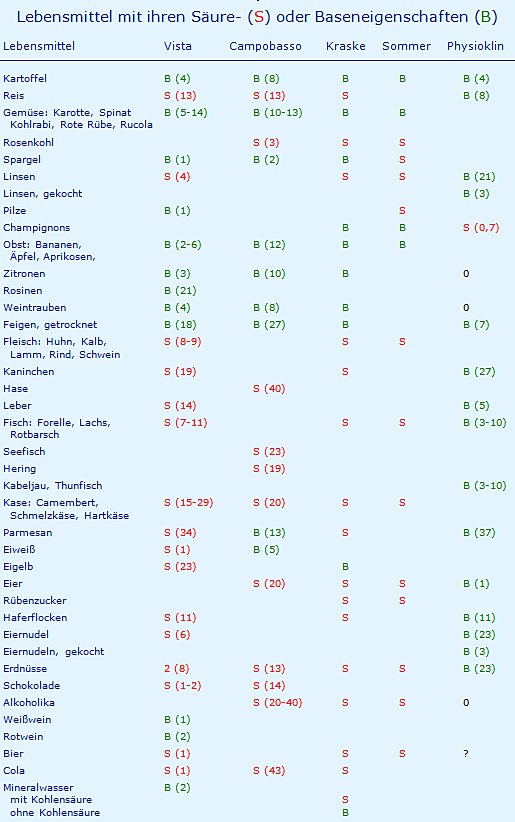
Zu dieser Tabelle werden folgende Kommentare abgegeben:
- Bei Vista werden die Basenbildner mit (PRAL -) und die Säurebildner mit (PRAL +) gekennzeichnet.
- Bei Campobasso wird ein Basenüberschuss mit + und ein Säureüberschuss mit – gekennzeichnet.
- Bei Kraske stimmt die Farbgebung der Legende nicht mit der Tabelle überein.
- Es ist offensichtlich, dass die Einordnung Säure oder Base je nach Autor unterschiedlich ausfallen kann. Die Einordnung erfolgt bisweilen „emotional“, Alkoholika sollen Säurebildner sein, Alkohol wird (s.u.) aber neutral verbrannt.
- Beim Fleisch liegt der pH-Wert Wert eine Stunde nach der Schlachtung bei 6,0 und nach 24 Stunden bei ca. 5,4 - 5,5, ähnlich der pH-Wert von Brühwurst, Rohwürste, Rohschinken, Kochschinken, Blutwurst, Leberwurst und Schweinebraten mit 4,8 - 6,3. Dies ist wichtig für die Zuordnung von Asparagin- und Glutaminsäure als Basen bzw. Lysin und Arginin als Säuren (s. Anhang).
- Kaninchenfleisch und Champignons fallen vermutlich deshalb aus der Reihe der alkalisierenden Lebensmittel, weil in der Tabelle der Zusammensetzung [12] Angaben über die alkalisierenden Asparaginsäure und Glutaminsäure fehlen (s. Tabelle im Anhang).
10.04.2019: Die fehlenden Werte für Asparaginsäure und Glutaminsäure wurden aus anderen Quellen entnommen, demzufolge wurden Champignons vom S (3) in S (0,7) und Kaninchenfleisch von S (26) in B (27) geändert (s. hierzu Tabelle im Anhang). - Am Beispiel der Zitrone soll die Problematik von organischen Säuren demonstriert werden, weil sie hier von allen Autoren als Basenbildner aufgeführt wird:
1 Zitrone von im Mittel 85 g wiegt ohne Schale ca. 60 g, der pH-Wert beträgt ca. 2,4, damit liegt die Zitronensäure praktisch vollständig als Säure vor. Wenn ihre Konzentration 4,68 g/100 g beträgt, dann enthält 1 Zitrone 2,8 g Zitronensäure, die bei einem Molekulargewicht von 192 gerade 14,6 mmol ausmachen und damit (dreiwertig) 44 Säure-Äquivalente (mmol) liefern. Dies führt nach Aufnahme im Organismus (15 l Extrazellularraum) zu einem vorübergehenden, harmlosen Base Excess von -2,9 mmol/l.
Da die Zitronensäure, vor allem in der Leber, schnell metabolisiert wird, ist der Säure-Basen-Haushalt spätestens nach 1 Stunde wieder ausgeglichen. Von einem Basenbildner könnte nur ausgegangen werden, wenn der pH-Wert der Zitrone mindestens 7,0 betragen würde. Dann nämlich läge die Zitronensäure als Salz (Base), also als Zitrat vor, und würde eine alkalisierende Wirkung ausüben. - Am Beispiel von Bier soll die Problematik von organischen Säuren erneut demonstriert werden: Wenn der pH angeblich 4,5 bis 5,0 beträgt, mit oder ohne CO2, dann könnte die Wirkung der vielen organischen Säuren nur dann beurteilt werden, wenn der pH ohne CO2 bekannt wäre. Würde er ohne CO2 in der Nähe von 7 liegen, wäre Bier eine alkalisierende Flüssigkeit, weil alle organischen Säuren als Basen vorlägen.
Daher enthält die Tabelle hier ein Fragezeichen. - Werden Lebensmittel gekocht, nimmt natürlich mit der Wasseraufnahme die metabolische Wirkung entsprechend ab (Linsen, Nudeln), umgekehrt, wenn sie getrocknet werden (Weintrauben, Rosinen).
10. J-These: Säure-Krise beim Fasten
Alltägliche Belastungen des Organismus durch Säuren und Gifte... z.B. beim Fasten.
Antithese
Da mit erstaunlicher Konsequenz immer wieder die These vertreten wird, beim Fasten würde der Organismus in eine Säure-Krise geraten [11], wurden 21 Probanden (20 Frauen, 1 Mann) während ihrer Fastenkur (Nulldiät mit Ausnahme von Brühe aus Brühwürfeln, großzügige Wasseraufnahme nach Bedarf) über 6 Tage beobachtet (2003). Nachdem bei 53 Probanden die tägliche Ausscheidung der aufgeführten Substanzen über den 24-Stunden-Sammelurin gemessen wurde, erfolgt dies nach gleichem Schema bei den Probanden unter der Fastenkur. Die Ergebnisse (gerundet) finden sich in der folgenden Tabelle.
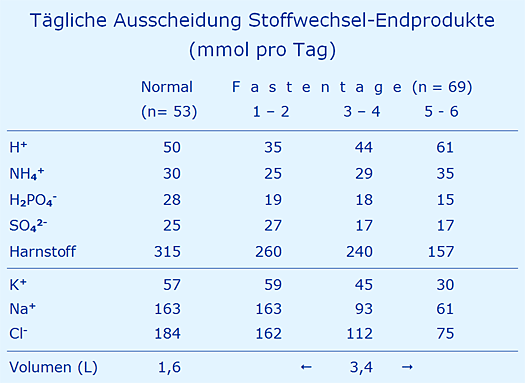
Dazu werden folgende Kommentare abgegeben:
- Die Sulfat-Ausscheidung wurde unter der Annahme gemessen, dass diese unter einer Nulldiät, also fehlende Eiweißaufnahme mit Methionin und Cystein, sehr rasch auf Null absinken sollte. Dies war offensichtlich auch am Tag 6 nicht der Fall, d.h. das Sulfat stammt – zumindest überwiegend – nicht aus der Nahrungsaufnahme.
Der anfängliche Anstieg der Sulfat-Ausscheidung dürfte auf die Darmreinigung mit Glaubersalz (Mg2SO4 bzw. Na2SO4) zu Beginn der Fastenkur zurückzuführen sein. - Die Ausscheidung von Säuren (H+) ändert sich nicht wesentlich, die Herkunft aus der Nahrung bleibt somit fraglich, eine Säure-Krise ist nicht erkennbar.
- Die Ausscheidung von Natrium, Kalium und Chlorid geht deutlich zurück, sobald die Zufuhr über die Nahrung ausfällt, das gleiche gilt für Phosphat.
- Die vermutlich aus der Schwefelsäure (25 Sulfat aus H2SO4) stammenden 50 H+ werden zur Hälfte als Ammonium und zur anderen Hälfte an Phosphat gebunden (H+ + HPO42- = H2PO4-) ausgeschieden.
- Der aus dem Eiweiß-Stoffwechsel stammende Harnstoff wird etwa auf die Hälfte reduziert.
- Das tägliche Urinvolumen von im Mittel 1,6 Liter wird – gewollt – deutlich auf im Mittel 3,4 Liter erhöht, also mehr als verdoppelt.
Anhang
Grundsätzliche Anmerkung zur Entsorgung von Stoffwechsel-Endprodukten aus dem Organismus
Die Entsorgung von Stoffwechsel-Endprodukten erfolgt immer über Zellmembranen (Lunge, Darm, Niere, Blutkapillaren), wobei der letzte Schritt immer über eine Diffusion erfolgt, ein passiver Transportmechanismus aufgrund einer Konzentrations-Differenz. Damit dieser Prozess ausreichend effektiv erfolgen kann, müssen die Austauschflächen möglichst groß gehalten werden, weil meist nur Strecken von wenigen Mikrometern (1/1000 mm) überwunden werden. Die Schätzungen aller Lungen-Alveolen, Darm-Mikro-Zotten, Nieren-Körperchen und Blutkapillaren liegen daher im Bereich von 80 - 100 m2. Ein Stoffaustausch, Kohlendioxid-Abgabe oder Säure-Elimination, über die vergleichsweise kleine Hautoberfläche von 1,6 - 1,8 m2 ist daher prinzipiell auszuschließen.
Metabolismus (Stoffwechsel) von Nahrungsmitteln und Säure-Basen-Haushalt
Organische Säuren
Grundsätzlich können alle Organe, vor allem die Leber als Haupt-Stoffwechselorgan, nur elektroneutral metabolisieren, d.h. wird der Leber eine organische Säure angeboten, z.B. mit dem Bier (s.o.) Äpfelsäure, Zitronensäure, Milchsäure, Oxalsäure, Bernsteinsäure, Fumarsäure, Glycolsäure, Brenztraubensäure oder Gluconsäure, dann werden diese vollständig zu den neutralen Endprodukten CO2 + H2O metabolisiert, somit erfolgt kein Einfluss auf den Säure-Basen-Status des Organismus.
Die Tatsache, dass das neutrale Gas CO2 möglicherweise zur Kohlensäure H2CO3 hydratisiert wird und anschließend in Bikarbonat + Wasserstoff-Ionen (HCO3- + H+) zerfällt (dissoziiert), übt keinen Einfluss auf den Säure-Basen-Status aus, solange das Gas über die Lunge eliminiert wird (s.u.).
Einen Sonderfall stellt die Milchsäure dar, weil sie in der Leber zur Neu-Synthese von Glukose verwendet (Gluko-Neogenese) oder auch vollständig zu CO2 + H2O metabolisiert (oxidiert) werden kann.
Selbst wenn dem Organismus große Mengen einer starken Säure, z.B. Zitronensäure (Zitrone), zugeführt werden, wird er vorübergehend eine Säurebelastung erfahren, die aber nach Verstoffwechslung dieser Säure aufgehoben ist.
Salze organischer Säuren
Diese sogenannten metabolisierbaren Anionen (Basen), also die Salze organischer Säuren, wie z.B. Malat (Äpfelsäure), Zitrat (Zitronensäure), Laktat (Milchsäure), Azetat (Essigsäure) Oxalat (Oxalsäure) oder Tartrat (Weinsäure), werden in der Medizin deshalb therapeutisch eingesetzt, um dem Organismus basische Substanzen zuzuführen, also zu alkalisieren.
Dieser Effekt der Alkalisierung resultiert aus der Tatsache, dass im Metabolismus (vor allem der Leber) nicht die Salze (geladene Anionen), sondern nur die ungeladenen Säuren metabolisiert werden können. Die Leber muss dazu pro Mol Anion (z.B. Laktat) ein Mol Wasserstoff-Ion (H+) einsetzten, also dem Organismus entziehen. Da die überall vorhandene Kohlensäure (H2CO3) dieses H+-Ion liefert, wird pro Mol Laktat ein Mol Milchsäure oxidiert und damit 1 Mol Bikarbonat (HCO3) freigesetzt.
Dieser Effekt der Alkalisierung ist dann besonders effektiv, wenn das Anion der Apfelsäure (Malat2-) oder der Zitronensäure (Zitrat3-) verwendet wird, weil die Äpfelsäure zwei- und die Zitronensäure dreiwertig ist, also jeweils 2 oder 3 H+-Ionen liefert.
Werden dem Organismus große Mengen einer starken Base, z.B. Zitrat, zugeführt, wird er für längere Zeit eine Alkalisierung erfahren bis die Niere diese Störung durch Ausscheidung von überschüssigem Bikarbonat (HCO3) kompensiert hat.
Säuren oder Basen
Die Frage, ob in einer Lösung mehr Säure oder Base vorliegt, kann nur mit dem Verhältnis von aktuellem pH-Wert und dem speziellen pK-Wert der Säure beurteilt werden.
Dies soll am Beispiel der Essigsäure bzw. ihrem Anion Azetat beschrieben werden.
Beim physiologischen pH von 7,40 muss die Essigsäure vollständig dissoziiert vorliegen, weil der pK der Essigsäure (37 °C) von 4,60 deutlich unterhalb von 7,40 liegt. Beim pH von 4,60 würden die beiden Konzentrationen Essigsäure und Azetat identisch sein, beim pH von 5,60 würde die Azetat-Konzentration 10 mal höher, beim pH von 6,60 schon 100 mal höher sein als die der Essigsäure.
Mit der Kenntnis von aktuellem pH und spezifischem pK kann man somit diese Frage eindeutig beantworten. Da die pK-Werte aller erwähnten organischen Säuren deutlich unterhalb von 7,40 liegen, betragen die Salz- bzw. Anionen-Konzentrationen immer ein Vielfaches der Säure-Konzentrationen.
Kohlenhydrate
Kohlenhydrate, z.B. Zucker (Glukose, Maltose, Arabinose, Galaktose), werden grundsätzlich zu CO2 + H2O metabolisiert (oxidiert).
Beispiel Glukose: C6H12O6 + 6 O2 = 6 CO2 + 6 H2O.
Gleiches gilt für Alkohol (Ethanol, Äthylalkohol): C2H6O + 3 O2 = 2 CO2 + 3 H2O.
Sie üben also keinen Einfluss auf den Säure-Basen-Status aus.
Aminosäuren
Bei den Bausteinen der Proteine (Eiweiße), den Aminosäuren (AS), gibt es zahlreiche neutralen AS, wie z.B. Alanin. Hier neutralisieren sich die Säure- (COOH, pK 2 - 3) und die basische Aminogruppe (NH2, pK 9 - 10) so, dass sie beim pH von 7,40 als Zwitter-Ion vorliegen, also COO- einerseits und NH3+ andererseits, mit der Folge, dass sie im Metabolismus keinen Einfluss auf den Säure-Basen-Status ausüben können.
Daneben gibt es AS mit zusätzlichen dissoziierenden Gruppen. Die sauren AS Asparagin- und Glutaminsäure liegen im mittleren pH-Bereich (s.u.) als Anionen vor, also als Basen, die H+-Ionen aufnehmen können (Protonen-Akzeptoren). Die basischen AS Lysin und Arginin hingegen wirken als Protonen-Donatoren, also AS mit säuernder Wirkung.
Diese etwas verwirrende Feststellung, Säuren wirken als Basen und Basen als Säuren, ist nur mit dem Verhältnis von pH und jeweiligem pK zu verstehen.
Der pH der proteinhaltigen Nahrungsmittel, z.B. Fleisch, Fisch oder Hühnereier, liegt im Bereich von 5,5 bis 8,5 und die pK-Werte der AS Asparagin- und Glutaminsäure liegen um den Wert 4, sodass diese als Salze bzw. Basen vorliegen. Umgekehrt die basischen AS Lysin und Arginin, deren pK-Werte bei 10 - 12 liegen, die also bei diesen pH-Werten (5,5 bis 8,5) als Säuren fungieren.
Schließlich gibt es noch die schwefelhaltigen AS Methionin und Cystein, die im Metabolismus SO3 freisetzen, das nach Hydratisierung (+ H2O) Schwefelsäure (H2SO4) bildet, dessen Sulfat (SO42-) über die Niere ausgeschieden wird.
Genaue Details zu diesen Ausführungen finden sich bei Zander 1995, insbesondere die Angaben, wieviel H+ pro 1 g der jeweiligen AS freigesetzt oder verbraucht wird.
In der folgenden Tabelle werden die Konzentrationen verschiedener Aminosäuren aufgeführt [12] und mit den Faktoren in Säure- oder Basenbildner umgerechnet (Faktoren (H+/g): Asn (-7,51), Glu (-6,80), Lys (+6,84), Arg (+5,74), Met (+13,4), Cys (+16,5)).
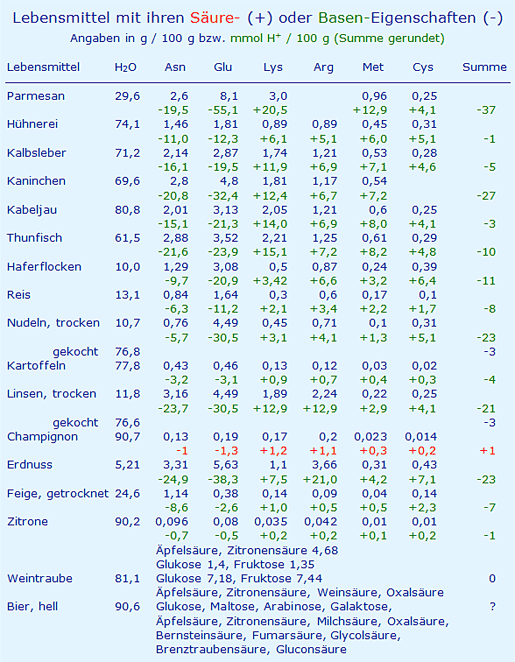
10.04.2019: Die o. g. Daten für Kaninchenfleisch und Champignons wurden mit den zugehörigen Angaben über die Zusammensetzung geändert (s. Tabelle im Text).
Säure-Bildung im Organismus und Säure-Basen-Haushalt
H2CO3 bzw. CO2
Im Stoffwechsel der Zellen entsteht das Gas CO2 und wird zum kleinen Teil zur Kohlensäure H2CO3 hydratisiert (CO2 + H2O = H2CO3). Der weit überwiegende Teil diffundiert als CO2 in den Extrazellularraum und von dort weiter ins Blut. Hier wird es schon mit sehr hoher Affinität „erwartet“, weil es hier wieder hydratisiert (H2CO3) und dann perfekt gepuffert wird. Das Hämoglobin puffert das H+ der H2CO3 praktisch unbegrenzt und damit entsteht im Blut die Transportform von CO2, nämlich das HCO3-, in sehr hoher Konzentration. Dies ist der entscheidende Grund für die Tatsache, dass die CO2-Transportkapazität des Blutes fast zehnmal höher ist als die für Sauerstoff. Gelangt das Blut dann zur Lunge, kehren sich die Verhältnisse gerade wieder um, d.h. aus dem HCO3- entsteht wieder die Säure H2CO3, die sehr rasch in CO2 + H2O zerfällt, damit das entstehende CO2 wieder als Gas in die Lungen-Alveole diffundieren kann, um dann mit der Atmung aus dem Körper eliminiert zu werden.
Um die Konzentrationsverhältnisse H2CO3 zu HCO3 klarzustellen (37 °C): Im gepufferten Blut-Plasma liegt unter Normalbedingungen ein pCO2 von 40 mmHg, ein pH von 7,40 und eine HCO3-Konzentration von 24 mmol/l vor und dabei nur eine sehr kleine Konzentration von 1,2 mmol/l H2CO3. Diese kleine, laufend nachlieferbare Konzentration ist an vielen Stellen (s.u.) die Quelle für benötigte H+-Ionen.
Schwefelsäure (H2SO4)
Beim Abbau von Methionin und Cystein, den schwefelhaltigen Aminosäuren, entsteht das Endprodukt SO3 und nach Hydratisierung die Schwefelsäure (H2SO4), die anstandslos täglich als 2H+ (z.B. gebunden an Phosphat) und SO42- über die Niere eliminiert wird.
Salzsäure (HCl)
Salzsäure im Magen wird energieintensiv in den Belegzellen gebildet, wobei einerseits Chlorid-Ionen (Cl-) und andererseits Protonen (H+) sezerniert werden, die aus der Reaktion von CO2 + H2O = H2CO3 (= HCO3- + H+) stammen. Der pH-Wert des (nüchternen) Magensaftes beträgt ca. 1,0 bis 1,5 mit der entsprechenden HCl-Konzentration von 30 (pH 1,5) bis 100 (pH 1,0) mmol/l. Bei einer täglichen Magensaft-Produktion von ca. 2 Litern bedeutet dies im ungünstigsten Falle, dass über das HCO3 enthaltende Pankreas-Sekret täglich 200 mmol HCl neutralisiert werden müssen (HCl + NaHCO3 = NaCl + CO2 + H2O). Dabei entstehen dann 200 mmol CO2, also aufgerundet 4.500 ml CO2 (Molvolumen = 22,4 ml/mmol). Diese beträchtliche Menge von 4,5 l CO2 täglich wird mit dem Blut zur Leber transportiert, wo ein Teil für den Metabolismus wieder Verwendung findet.
Ammonium) (NH4+) bzw. Ammoniak-Gas (NH3)
Das im Stoffwechsel, vor allem der Leber, entstehende Ammoniak-Gas (NH3), eine sehr gut diffusible starke Base (pK 9,0), erscheint nach Aufnahme von H+ als die Säure Ammonium (NH4+). Wegen seiner extrem hohen Toxizität kann dies nicht im Blut transportiert werden. Aus diesem Grunde müssen spezielle Transportmoleküle von der Leber, dem Hauptlieferanten von NH3 bzw. NH4+, zur Niere verwendet werden, nämlich Harnstoff und Glutamin. Bei der hepatischen Harnstoffsynthese entsteht neutral aus 1 mol CO2 plus 2 mol NH3 eine neutrale, sehr gut diffusible Substanz, die keinen Einfluss auf den Säure-Basen-Haushalt hat.
Bei der Harnstoffproduktion und der Glukoneogenese (Neubildung von Glukose aus Milchsäure) kommt es zu der besonderen Tatsache, dass die Leber als einziges Organ CO2 wie folgt verbraucht.
Pro Mol Harnstoff wird 1 Mol CO2 verbraucht, das macht bei einer täglichen Harnstoff-Bildung von 500 mmol immerhin 11.200 ml pro Tag (500 x 22,4 s.o.) bzw. 7,8 ml pro Minute.
Im Rahmen der Glukoneogenese (s.u.) werden aus 2 Mol Natrium-Laktat unter Verbrauch von CO2 (und Wasser) 1 Mol Glukose plus Bikarbonat gebildet ( 2 CH3CH(OH)COONa + 2 H2O + 2 CO2 → C6H12O6 + 2 NaHCO3). Dies kann bei vollständiger Glukoneogenese der Milchsäure (75 mmol/h) immerhin 75 mmol CO2 pro Stunde bzw. 1,25 mmol pro Minute und damit 28 ml CO2 pro Minute ausmachen.
Zusammen mit den 7,8 ml aus der Harnstoffbildung plus diesen 28 ml aus der Glukoneogenese verbraucht die Leber damit 35,8 ml CO2 pro Minute, ein Betrag der immerhin 17 % der CO2-Produktion des Gesamtorganismus in körperlicher Ruhe (210 ml/min) ausmachen kann.
Dass die Leber tatsächlich CO2 verbraucht, wurde im Tierversuch elegant nachgewiesen: Im Gegensatz zum organüblichen Anstieg des pCO2 von der Leber-Arterie zur -Vene (+7,2 mmHg) fällt der pCO2 im „Stoffwechsel-Weg“ der Leber von der Portal-Vene (enthält das Blut vom Magen-Darm-Trakt) zur Leber-Vene leicht ab (-0,7 mmHg) und der pH steigt [Nöldge-Schomburg et al. 1995]. Die Durchblutung über beide Leber-Kreisläufe verteilt sich zu 25 % auf den Organteil und zu 75 % auf den „Stoffwechsel-Weg“ der Leber, dies macht die Bedeutung der Leber als Stoffwechsel-Organ deutlich. Immerhin erhält die Leber 25 % der jede Minute vom Herzen ausgeworfenen Blutmenge (Herz-Zeit-Volumen).
Kommt es zu einer Drosselung der Harnstoffsynthese in der Leber, wird Ammonium zunehmend über eine hepatische Glutaminbildung entgiftet, d.h. Glutamin wird zur Niere transportiert, dort kommt es zur Glutaminspaltung und somit zu einer Ammonium-Ausscheidung über die Niere. Somit dient Glutamin als nichttoxische Transportform für Ammonium zwischen Leber und Niere.
Milchsäure (C3H6O3, CH3 CHOH COOH)
Auch in körperlicher Ruhe bilden viele Organe Milchsäure (z.B. Erythrozyten, Muskel, Nebenniere etc.), und zwar ca. 1 mmol pro Stunde und kg Körpergewicht, bei 75 kg KG also ca. 75 mmol pro Stunde. Sie liegt im Organismus in dissoziierter Form vor, also H+ und Laktat-Anion. Die H+-Ionen werden perfekt gepuffert (s.o.) und das Laktat-Anion gelangt zur Leber und wird dort verstoffwechselt (oxidiert), nämlich zu CO2 und H2O oder zur Glukoneogenese (s.o.) verwandt. In beiden Fällen wird pro Mol Laktat 1 Mol H+ aus der H2CO3 stammend, verbraucht, also eliminiert und damit HCO3 freigesetzt.
Dass die Leber tatsächlich Laktat und H+ verbraucht wurde ebenso im Tierversuch nachgewiesen: Von der Portal-Vene (enthält das Blut vom Magen-Darm-Trakt) zur Leber-Vene fällt nicht nur die Laktat-Konzentration ab (0,4 mmol/l) sondern auch der Base Excess (0,8 mmol/l), damit steigt der pH-Wert an. Gleichzeitig bleiben beide Größen auf dem Weg von der Leber-Arterie zur -Vene praktisch konstant [Nöldge-Schomburg et al. 1995].
Einladung zur Diskussion
Beiträge von Lesern, die relevante und sachlich begründete Argumente enthalten, werden hier – im Einvernehmen mit dem Autor – gerne aufgenommen.
Literatur
- P. Jentschura, J. Lohkämper
Gesundheit durch Entschlackung (Download in Auszügen). Verlag Peter Jentschura, Münster - R. Jentschura
Sport aber richtig – unter Beachtung des Säure-Basen-Haushaltes (Download).
Verlag Peter Jentschura, Münster - U. Jentschura, R. Jentschura
Ratgeber „Fasten ohne Krisen“ (Download).
Verlag Peter Jentschura, Münster - Dr. Volker Anhäusser (myBody.Inc.), Ulrich Arndt (horusmedia), Dr. med. Simon Feldhaus (Arbeitskreis für Mikrobiologische Therapie e.V.), Sebastian Ganske, Frank-H. Häger (Vital.de, Fuersie.de, 4 Seasons digital.net), Peter Jentschura (Verlag P. Jentschura), Roland Jentschura (Verlag P. Jentschura), Ute Jentschura (Verlag P. Jentschura), Dr. Peter Magdics (Wien), Marike Stucke (4 Seasons digital.net), Stanislav Sotnikov (Naturax), Prof. Dr. rer. nat. Jürgen Vormann (Institut für Prävention und Ernährung), NN (Schuessler-salze-ratgeber.de; FirstLevel Media Deutschland; Zentrum der Gesundheit)
- Zander R
Lebermetabolismus und Säure-Basen-Haushalt
Anästhesiol Intensivmed Notfallmed Schmerzther 1995; 30 (Suppl. 1): 48 - 51 - Nöldge-Schomburg G, Armbruster K, Geiger K, Zander R
Experimentelle Untersuchungen zum Säure-Basen-Haushalt und Laktatmetabolismus der Leber.
Anästhesiol Intensivmed Notfallmed Schmerzther 1995; 30 (Suppl. 1): 43 - 47 - Vista – Schweizer Gesundheitsmagazin (Fa. Sanatrend AG, 8173 Neerach (Schweiz), Website, eingesehen am 02.03.14
- Campobasso A
Stopp! Die Umkehr des Alterungsprozesses (6. Aufl.), Arkana, München 2008 - Kraske E-M
Wie neugeboren durch Säure-Basen-Balance.
Gräfe und Unzer, München 1996 - Sommer P, Uhlenbruck G
Immunfit forever – Gesund und fit bis 100.
Arsnova, Sobernheim 2003 - Berndt, C
Zum Thema Fasten wird Herr Prof. Dr. Hans Hauner (München) mit der Bemerkung zitiert (Süddeutschen Zeitung 01.03.2014), mitunter löse das Fasten neben… Übersäuerung… sogar Depressionen aus…
Der Bitte um Überlassung eines entsprechenden Zitats durch Herrn Hauner wird nicht entsprochen. - Souci SC, Fachmann W, Kraut H
Die Zusammensetzung der Lebensmittel (5. Aufl.).
Medpharm, Stuttgart 1994
