
Deklarierung der Inhaltsstoffe
Einwaage oder fertige Lösung?
Das Arzneimittelgesetz verlangt vom pharmazeutischen Hersteller, alle Inhaltsstoffe zu deklarieren. Dies muss erfolgen über die Einwaage (z. B. g/l) sowie die Zusammensetzung der fertigen Lösung (mmol/l bzw. g/l bei Proteinen). Für den Arzt entscheidend aber ist die Zusammensetzung der fertigen Lösung.
Obwohl zulässig, käme niemand auf die Idee, eine sogenannte physiologische Kochsalz-Lösung mit 0,9 g/dl NaCl („0,9 %“, 9 g/l) wie folgt zu deklarieren:
Einwaage: 154 ml einer 1 m Salzsäure (HCl) + 6,16 g NaOH ad 1 l Lösung.
Zusammensetzung der Lösung: 154 mmol/l Na+, 154 mmol/l Cl-.
Typische Beispiele für das Missverhältnis zwischen deklarierter Einwaage und tatsächlicher späterer Zusammensetzung sind:
- Eingewogenes HCO3- ist beim pH der Lösung von 5,1 nicht mehr vorhanden (Hepasteril, Fresenius) sondern als CO2 entwichen [Zander 1993 (B)].
- Die Einwaage von 30 mmol/l Azetat (Tutofusion K 80, Baxter) erzeugt beim pH der fertigen Lösung von 4,9 tatsächlich eine Azetatkonzentration von nur 20 mmol/l bei immerhin 10 mmol/l Essigsäure [Zander 1995 (E)].
Säure-Basen-Haushalt
Die Deklarierung der Zusammensetzung, und zwar in mmol/l, muss für den Arzt eindeutige Angaben über eventuelle Wirkungen auf den Säure-Basen-Haushalt des Patienten enthalten. Die nicht geeignete Titrationsazidität (TA, mmol/l) ist durch BE und BEpot zu ersetzen.
pH-Wert: Die Angabe des pH-Wertes erfolgt regelmäßig und ist für den Arzt praktisch ohne Bedeutung. Die Werte liegen meist im Bereich von 5 - 6.
Titrationsazidität (TA, mmol/l): Dies ist diejenige Menge an OH--Ionen (mmol/l), die notwendig ist, den pH-Wert der Lösung im Labor auf 7,40 zu titrieren, und zwar bei 37 °C und pCO2 von 0 mmHg. Sie kann gemessen oder aufgrund der Zusammensetzung auch berechnet werden. Ihre Angabe ist verpflichtend, manchmal offensichtlich falsch (32 mmol/l, Parenteral EK G 5, Serag-Wiessner) [Zander 2002 (D)] oder mit einem zu großzügigen Bereich (12 - 25 mmol/l, Aminosteril N-Hepa 8 %, Fresenius Kabi) angegeben [Zander 1995 (E)]. Die Werte liegen zwischen < 1 mmol/l für Elektrolytlösungen und 55 mmol/l, wenn die Lösungen Aminosäuren oder Phosphat enthalten [Zander 1995 (E)].
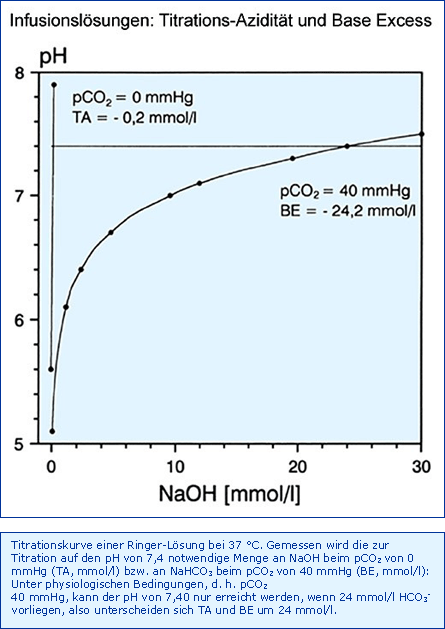
Base Excess (BE, mmol/l): Eine Infusionslösung mit einem pH von 7,40 und einer Bikarbonatkonzentration von 24 mmol/l wäre physiologisch zusammengesetzt. Fehlt der Infusionslösung die physiologische Pufferbase Bikarbonat, muss der Organismus das fehlende HCO3- von 24 mmol/l nach Infusion ersetzen. Diese Tatsache wird mit dem Base Excess BE einer Lösung in vitro, in Analogie zu Blut, definiert: Die Messung oder Berechnung derjenigen Menge an HCO3- (mmol/l), die notwendig ist, den pH-Wert der Lösung auf 7,40 zu titrieren, und zwar bei 37°C aber, im Gegensatz zur TA, jetzt bei pCO2 von 40 mmHg. Der BE kann gemessen oder aufgrund der Überlegung ermittelt werden, dass das Fehlen von 24 mmol/l HCO3- einem BE von - 24 mmol/l entsprechen muss. Angegebene Werte liegen zwischen - 24 und - 84 mmol/l [Zander 2002 (D)].
Potentieller Base Excess (BEpot, mmol/l): Soll der negative BE einer Infusionslösung über den Zusatz sogenannter metabolisierbarer Anionen möglicherweise, d. h. potentiell, kompensiert werden, wird zur Charakterisierung dieser Infusionslösung der sogenannte potentielle Base Excess BEpot vorgeschlagen [Zander 1993 (B), 1995 (E), 2002 (D)]. Der BEpot einer Infusionslösung ist diejenige Menge an HCO3-, die nach Infusion plus Verstoffwechselung im Organismus verbraucht oder freigesetzt werden kann. Dieser Wert ergibt sich aus der Addition von BE (mit negativem Vorzeichen) in mmol/l und der Summe der metabolisierbaren Anionen, unter Berücksichtigung der Wertigkeit (Azetat, Laktat, Glukonat einwertig, Malat zweiwertig, Zitrat dreiwertig) ebenfalls in mmol/l. Angegebene Werte liegen zwischen + 31 und - 227 mmol/l [Zander 2002].

